
- •Ступко т.В.
- •Введение
- •Методические рекомендации
- •1. Основные понятия химии
- •«Масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции».
- •Номенклатура неорганических соединений
- •1 ‑ Моно 4‑ тетра 7 – гепта 10 ‑ дека
- •Названия одноатомных катионов
- •Названия многоатомных катионов
- •Традиционные названия кислот и кислотных остатков
- •Структурные формулы некоторых веществ
- •Общие химические свойства основных классов неорганических веществ
- •Изменение цвета индикаторов в растворах
- •Основные способы получения солей
- •Строение вещества
- •2.1. Строение атома.
- •Характеристики основных элементарных частиц атома
- •Возможные значения квантовых чисел
- •Заполнение электронами электронных орбиталей многоэлектронных атомов
- •Сопоставление разных типов радиусов натрия и хлора
- •Периодический закон и периодическая система элементов д.И.Менделеева
- •Молекулы, кристаллы, химическая связь
- •Длина химической связи. При образовании химической связи всегда происходит сближение атомов ‑ расстояние между ними меньше, чем сумма радиусов изолированных атомов:
- •Длины некоторых простых и кратных связей
- •Энергии некоторых простых и кратных связей
- •Зависимость структуры ионного кристалла от величины ионных радиусов
- •Поляризация ионов
- •Тип гибридизации и геометрия молекулы
- •Полярность ковалентной связи
- •Температуры кипения водородных соединений элементов VI a группы
- •Учение о химическом процессе
- •3.1. Элементы химической термодинамики
- •Контрольные вопросы13
- •Кинетика. Химическое равновесие.
- •Кинетика гетерогенных химических реакций
- •Каталитические процесс.
- •Сложные реакции
- •4. Химические процессы в растворах
- •Растворы неэлектролитов.
- •Растворы электролитов. Теория электролитической диссоциации.
- •Ионизация воды .РН растворов
- •Растворимость малорастворимых электролитов. Произведение растворимости.
- •Ионные реакции в растворе
- •Гидролиз солей
- •Контрольные вопросы19
- •Окислительно-восстановительные процессы
- •Примеры окислителей и восстановителей
- •Классификация окислительно-восстановительных реакций
- •Критерий протекания окислительно-восстановительных реакций. Электродный потенциал
- •I полуэлемент мостик kCl II полуэлемент
- •Виды химических источников тока
- •4.3. Реакции комплексообразования
- •Номенклатура комплексных соединений
- •Тип гибридизации электронных орбиталей комплексообразователя и структура комплексного соединения
- •Изомерия комплексных соединений
- •Основные типы комплексных соединений
- •Устойчивость комплексных соединений в растворе
- •Контрольные вопросы26
- •Заключение
- •Список рекомендуемой литературы
- •Содержание
Тип гибридизации и геометрия молекулы
|
Тип гибридизации |
Геометрическая форма |
Угол связи |
Примеры | |
|
sp |
линейная |
|
180o |
BeCl2 |
|
sp2 |
треугольная |
|
120o |
BCl3 |
|
sp3 |
тетраэдрическая |
|
109,5o |
CH4 |
|
sp3d |
тригонально-бипирамидальная |
|
90o; 120o |
PCl5 |
|
sp3d2 |
октаэдрическая |
|
90o |
SF6 |
Образование ковалентной химической связи по донорно-акцепторному механизму рассмотрим на примере образования иона аммония NH4+ при взаимодействии аммиака NH3 с катионом водорода H+. При донорно-акцепторном механизме образования ковалентной связи связь также образуется с помощью электронных пар. Однако в этом случае один атом – донор (атом азота) предоставляет свою электронную пару, а другой атом – акцептор (ион водорода) участвует в образовании связи своей свободной орбиталью.
В молекуле NH3 три электронные пары образуют три связи N–H, четвертая, принадлежащая атому азота электронная пара является неподеленной. Эта электронная пара может дать связь с ионом водорода, который имеет свободную орбиталь (рис.21.). В результате получается ион аммония NH4+, в котором все четыре ковалентных связи N–H равноценны. В ионе аммония невозможно выделить связь, образованную по донорно-акцепторному механизму

донор акцептор 4 ковалентные σ-связи
Рис.21. Возникновение ковалентной связи по донорно-акцепторному механизму
Метод валентных связей часто не может объяснить строение молекулы, не учитывая делокализацию связи, то есть предположение, что химическая связь образуется между более чем двумя атомами. Для примера приведем строение молекулы азотной кислоты (рис.22).

Рис.22. Строение молекулы азотной кислоты с позиции МВС.
Метод молекулярных орбиталей (ММО).
Основные положения:
Каждый электрон находится в поле всех ядер. Связь делокализована.
При этом связь не обязательно образована парой электронов.
При комбинации атомных орбиталей (АО) образуются молекулярные орбитали (МО)
Количество равно сумме атомных орбиталей
Электроны на молекулярных орбиталях размещаются по тем же принципам, что и на атомных орбиталях (принцип минимума энергии, Паули, Хунда)
Молекулярные орбитали бывают связывающие, разрыхляющие и несвязывающей.
В общем случае, волновые функции, отвечающие молекулярным орбиталям в двухатомной молекуле, представляют как сумму и разность волновых функций атомных орбиталей, умноженных на некоторые постоянные коэффициенты, учитывающие долю атомных орбиталей каждого атома в образовании молекулярных орбиталей (они зависят от электроотрицательности атомов). Так для молекула АВ:
ψ(АВ) = с1ψ(А) ± с2ψ(В)
Так, при образовании молекулы водорода Н2 из двух s-орбиталей атомов водорода формируются две молекулярные орбитали (рис.23). Одна из них связывающая (ее обозначают σсв), другая ‑ разрыхляющая (σ*).

Рис.23. Схема образования МО из 1s-АО.
Энергии связывающих орбиталей ниже, чем энергии атомных орбиталей, использованных для их образования. Электроны, заселяющие связывающие молекулярные орбитали, находятся преимущественно в пространстве между связываемыми атомами. Энергии разрыхляющих орбиталей выше, чем энергии исходных атомных орбиталей. Заселение разрыхляющих молекулярных орбиталей электронами способствует ослаблению связи: уменьшению ее энергии и увеличению расстояния между атомами в молекуле. Электроны молекулы водорода, ставшие общими для обоих связываемых атомов, занимают связывающую орбиталь (рис.24).

Рис. 24. Энергетическая диаграмма молекулы водорода
Из распределения электронов по молекулярным орбиталям можно рассчитать порядок связи (ω). Из числа электронов, расположенных на связывающих орбиталях – N1, вычитают число электронов, находящихся на разрыхляющих орбиталях‑N2, и результат делят на 2n (в расчете на n связей):
 .
.
Из диаграммы видно, что порядок связи в молекуле водорода равен 1. Электронную формулу молекулы водорода можно записать так – H2 (σсв)2, то есть на σсв МО находятся 2 электрона.
В отличие от МВС метод молекулярных орбиталей позволяет объяснить образование связи с порядком меньше 1. Так для ионов H2+и H2- порядок связи равен 0,5 (рис.25).
ММО объясняет, почему не возможно образование двухатомной молекулы гелия Не2 (рис. 26). Электронная формула такой молекулы Не2(σсв)2 (σ*)2. Порядок связи (2-2)/2 = 0, то есть, связи нет. Однако возможно образование иона Не2+(σсв)2 (σ*)1.Порядок связи (2-1)/2 =0,5. Частица не устойчивая, но существует.
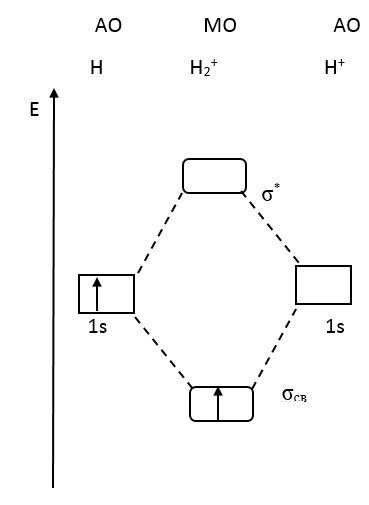

Рис. 25. Энергетическая диаграмма H2+и H2-


Рис. 26. Энергетическая диаграмма молекулы Hе2 и иона Не2+
Комбинация р-орбиталей приводит к двум типам молекулярных орбиталей. Из двух р-орбиталей взаимодействующих атомов, направленных вдоль линии связи, образуются связывающая σсв и разрыхляющая σ*орбитали.

Комбинации р-орбиталей, перпендикулярных линий связи, дают две связывающих πсв и две разрыхляющих π*орбитали.

Заполнение электронами МО в молекулах р-элементов происходит в тои порядке, который указан на рисунке 27.

Рис. 27. Энергетическая диаграмма гомонуклеарных молекул р-элементов 2 периода (а) – О2, F2 (б) B2, C2, N2.
Напишем электронную формулу молекулы кислорода О2. В атоме кислорода О 8 электронов, электронная формула – 1s22s22p4, валентный уровень 2s22p4 – 6 электронов, у двух атомов кислорода 12 электронов на МО. Электронная формула О2 (σсв)2(σs*)2(σсв)2(πсв)4(π*)2 (рис.28). Порядок связи (8-4)/2=2.
В молекуле азота N2 10 электронов на МО. Электронная формула (σсв)2(σs*)2(σсв)2(πсв)4. Порядок связи (8-2)/2=3.
Химические частицы, содержащие неспаренные электроны, обладают парамагнитными свойствами (в отличие от диамагнитных свойств химических частиц, все электроны в которых спарены). Парамагнетиками являются все вещества, состоящие из химических частицы с нечетным числом электроном, например NO. Метод молекулярных орбиталей позволяет выявить парамагнетики среди веществ, состоящих из химических частиц с четным числом электронов, например О2, в молекуле которого два неспаренных электрона находятся на двух разрыхляющих π*-орбиталях.

Рис. 28. Энергетическая диаграмма молекулы О2.





