
физ химия / новая папка Савельев / Новая папка / лекция К
.doc2. термохимия
Любая хим. реакция сопровождается поглощением или выделением теплоты - тепловым эффектом. Раздел ФХ, изучающий тепловые эффекты химических реакций называется ТЕРМОХИМИЕЙ. Термохимическими называют такие уравнения химической реакции, в которых наряду с формулами веществ, участвующих в реакции, указывается и тепловой эффект реакции
Пример Реакцию спиртового брожения глюкозы можно представить как:
С6Н12О6→2С2Н5ОН+2СО2; ΔН= -71,56 кДж/моль
где ΔН - тепловой эффект реакции в изобарно-изотермических условиях.
Тепловым эффектом хим. реакции называется теплота, выделяющаяся или поглощающаяся при реакции, если в системе: не совершается полезная работа, неизменны давление или объем системы, постоянство температуры до и после реакции, или иными словами реакция должна протекать в изобарно-изотермических или изохорно-изотермических условиях. Тепловой эффект обозначается как Q и измеряется в Дж/кмоль. Теплота экзотермических реакций считается положительной (ΔH < 0 и ΔU < 0)., а эндотермических - отрицательной (ΔH > 0, ΔU > 0).
Закон Гесса
Определить тепловой эффект можно по закону Гесса, который формулируется как: при p=const или V=const тепловой эффект химической реакции зависит только от вида и состояния исходных веществ и продуктов реакции, но не зависит о пути перехода
Закон
Гесса можно проиллюстрировать. Через
и 2 обозначим исходное (до реакции) и
конечное состояние (после реакции)
системы. Процесс превращения исходных
веществ в продукты можно осуществить:
1) непосредственно реакцией, тепловой
эффект которой обозначим как
![]() или 2) тремя реакциями, тепловые эффекты
которых равны соответственно
или 2) тремя реакциями, тепловые эффекты
которых равны соответственно
![]() ,
,
![]() ,
,
![]() .
Закон Гесса утверждает, что
.
Закон Гесса утверждает, что
![]() =
=![]() +
+
![]() +
+
![]()
Рассмотрим процесс горения углерода, его можно провести непосредственно или через две стадии:
![]() 2.1.1
2.1.1
 2.1.2
и 2.1.3
2.1.2
и 2.1.3
Просуммировав (2.1.2) и (2.1.3), получим:
![]() 2.1.4
2.1.4
Из сопоставления (2.1.1) и (2.1.4) видно, что
![]() 2.1.5
2.1.5
Закон Гесса можно сформулировать по-иному: тепловой эффект реакции не зависит от пути процесса, а зависит от начального и конечного состояния системы. Из этой формулировки следует, что тепловой эффект реакции есть функция состояния, что противоречит первому закону термодинамики. Это объясняется тем, что закон Гесса справедлив только для частных случаев: для процессов, протекающих при постоянном объеме или давлении. Для этих процессов он легко выводится из первого закона термодинамики
![]()
так как рdV=0, то δQv=dU откуда, проинтегрировав в пределах двух состояний, получим
![]() 2.1.6
2.1.6
 2.1.7
2.1.7
Поскольку внутренняя энергия системы является функцией состояния, то и тепловой эффект реакции, протекающей при постоянном объеме, есть функция состояния.
Выражение
![]() =-ΔU
показывает, что причиной выделения
теплоты при протекании химической
реакции при V=
соnst;
является убыль внутренней энергии.
=-ΔU
показывает, что причиной выделения
теплоты при протекании химической
реакции при V=
соnst;
является убыль внутренней энергии.
2) р = соnst
Выражение проинтегрируем в пределах двух состояний
 2.1.8
2.1.8
Перейдем к термохимическим значениям
 2.1.9
и 2.1.10
2.1.9
и 2.1.10
Сгруппируем члены относительно начального и конечного состояния системы
 2.1.11
2.1.11
Для расчета Qр надо знать, как измеряется функция U+pV. Эта функция называется энтальпией и обозначается буквой Н.
Термодинамическая теплота равна изменению энтальпии
![]() 2.1.12
2.1.12
Поскольку внутренняя энергия является функцией состояния, объем не зависит от пути процесса, а давление постоянное, то энтальпия также является функцией состояния и, следовательно, не зависит от пути процесса. Выражение Qp=-ΔН показывает, что причиной выделения теплоты при протекании реакции при постоянном давлении является убыль энтальпии системы.
Определение тепловых эффектов по теплоте образования, сгорания.
Расчет тепловых эффектов
Для определения теплового эффекта в термохимических уравнениях пользуются следствиями из закона Гесса. Таких следствий два.
1) Первое следствие формулируется как:
тепловой эффект хим. реакции равен разности теплоты образования продуктов реакции и теплоты образования исходных веществ, взятых в стехиометрических коэффициентах
Теплота образования - это кол-во теплоты, которое выделяется или поглощается при образовании одного киломоля соединения из составляющих его простых веществ.
Теплоты образования позволяют рассчитывать тепловой эффект реакции, не осуществляя опытов. В целях сопоставления и использования для расчетов, теплоты образования хим. соединений вычислены для стандартных условий (Т=298 К, р=1атм). Они называются стандартными теплотами образования и обозначаются ΔН°обр или ΔН°f,298
Например, теплота образования хлорида натрия в станд. условиях равна тепловому эффекту реакции образования его из металлического натра и газообразного хлора, т.е.
Na+1/2Cl2→NaCl + 410,9 ΔН°f ,298 = -410.9 кДж
Представим это следствие в общем виде:
 2.1.14
2.1.14
Тепловой эффект этой реакции для стандартных условий будет иметь вид
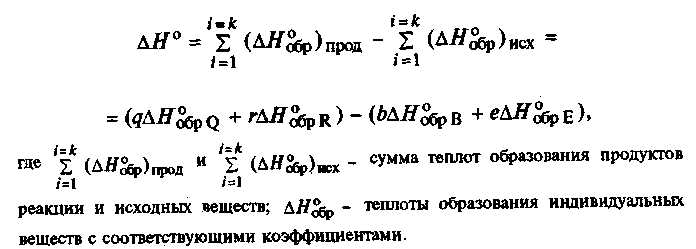 2.1.15
2.1.15
Из равенств (2.1.14) и (2.1.15) следует, что тепловой эффект обратной реакции равен тепловому эффекту прямой реакции, взятой с противоположным знаком (в случае обратной реакции ее продукты становятся исходными веществами, а исходные вещества - продуктами реакции).
Теплота образования простых веществ, таких как Н2, О2 принята нулю. Значения ΔН°f,298 приводятся в справочных таблицах.
Например,

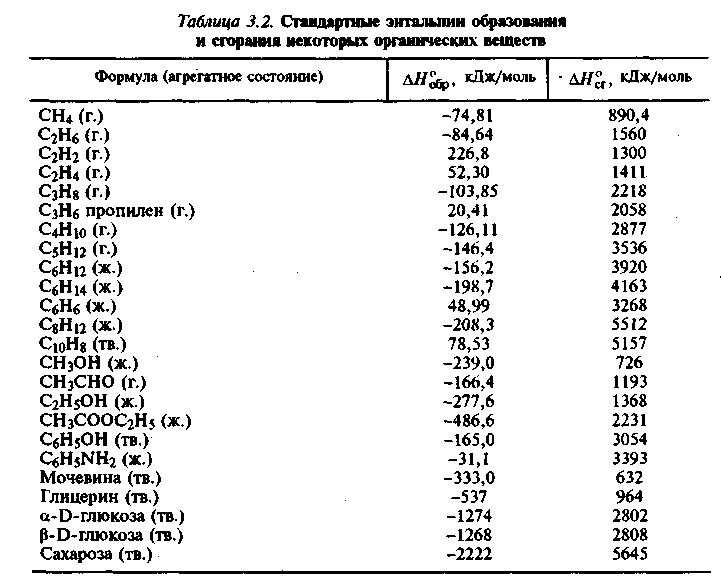


Итак, для расчетов тепловых эффектов реакции необходимо знать теплоты образования исходных веществ и продуктов реакции. Данные о теплоте образования экспериментально получают в калориметре (Зимон).
Определение тепловых эффектов по теплоте сгорания
Тепловой эффект реакции можно определить по теплоте сгорания веществ, участвующих в реакции. Для этой цели можно воспользоваться
2) вторым следствием из закона Гесса, которое формулируется следующим образом:
тепловой эффект химической реакции равен разности теплоты сгорания исходных веществ и теплоты сгорания продуктов реакции с учетом стехиометрических коэффициентов.
Теплота сгорания - это тепловой эффект реакции полного сгорания 1 моля вещ-ва при условии, что исходные вещества и продукты находятся в стандартных условиях. Обозначают ΔН°с,298
Аналогично уравн. 2.1.15 можно получить выражение для определения теплового эффекта реакции через теплоту сгорания:
 2.1.16
2.1.16
Под теплотой сгорания подразумевают тепловой эффект реакции окисления данного соединения кислородом до образования высших оксидов элементов или соединений этих элементов.
Значения теплоты сгорания используют для определения тепловых эффектов реакций главным образом органических соединений. Теплота сгорания высших оксидов =0.
По известной теплоте сгорания можно определить теплоту образования. Покажем эту возможность на примере бензола, стандартная теплота сгорания которого составляет ΔН°с,298 = -3268 кДж/моль.
Термохимическое уравнение сгорания бензола выглядит следующим образом:

Теплоту сгорания, так же как и теплоту образования, измеряют при помощи калориметра.
Зависимость теплового эффекта реакции от температуры. Закон Кирхгофа.
Рассмотренные ранее расчеты тепловых эффектов на основе законов Гесса по теплотам образования и сгорания ограничены стандартными условиями. Для практических целей необходимо рассчитать тепловые эффекты для конкретных условий, отличных от стандартных..
Тепловые эффекты хим. реакций зависят не только от природы реагирующих веществ, но и от внешних условий, прежде всего от температуры. Зависимость тепловых эффектов от температуры можно установить термодинамически.
Ранее на основании закона Гесса, мы установили что
-
изменение теплоты при p=const выражается через изменение энтальпии
 .
.
-
тепловой эффект реакций, протекающих при V=const выражается как изменение внутренней энергии

Продифференцировав по температуре эти два уравнения, получим:
![]() 2.1.17
2.1.17
 2.1.18
2.1.18
где производная энтальпии по температуре - это теплоемкость при постоянном давлении, а производная внутренней энергии по температуре - теплоемкость при постоянном давлении
Уравнения (2.1.17) и (2.1.18) можно представить в несколько измененном виде:
![]()
Эта закономерность была установлена Кирхгофом. Закон Кирхгофа читается так: температурный коэффициент теплового эффекта равен приращению теплоемкости в результате протекания процесса.
Закон Кирхгофа в дифференциальной форме позволяет определить лишь изменение теплового эффекта с изменением температуры, а не величину самого теплового эффекта.
Чтобы найти значения теплового эффекта в зависимости от температуры, необходимо проинтегрировать уравнения 2.1.19 и 2.1.20 от Т до Т° (где Т и Т° - соответственно требуемая и стандартная температура), от ΔН до ΔН ° и от ΔU до ΔU° (где ΔН и ΔU - соответственно энтальпия и внутренняя энергия в условиях, отличающихся от стандартных). Интегрирование проводится для двух случаев: первого, когда ΔСр = const и ΔСv = const, и второго, когда ΔСр ≠ const и ΔСv ≠ const. После разделения переменных результаты интегрирования уравнений (2.1.19) и (2.1.20) в первом случае следующие:
 2.1.21
и 2.1.22
2.1.21
и 2.1.22
Таким образом, для определения теплового эффекта ΔН или внутренней энергии ΔU при любой температуре Т, помимо теплоты процесса в стандартных условиях ΔН ° (или ΔU°), необходимо знать еще и изменение теплоемкости ΔСр и ΔСv.
Если учитывать зависимость теплоемкости от температуры (Cр = a + bT + cT2) то
![]() 2.1.23
2.1.23
После подставки (2.1.23) в (2.1.21, 2.1.22) и интегрирования получим расчетную формулу Кирхгофа:
![]() 2.1.24
2.1.24
Если бы взяли неопределенный интеграл от (2.1.21, 2.1.22), то получили бы:
 2.1.25
2.1.25
где
![]() —
постоянная интегрирования, которую
чаще всего определяют по стандартной
теплоте химической реакции.
—
постоянная интегрирования, которую
чаще всего определяют по стандартной
теплоте химической реакции.
Итак закон Кирхгофа в интегральной форме дает возможность, не прибегая к эксперименту, рассчитывать тепловые эффекты при любой температуре по известному тепловому эффекту в стандартных условиях.
