
физ химия / новая папка Савельев / Новая папка / второй закон
.doc. Второй закон термодинамики. Энтропия
Первый закон термодинамики определяет энергетический баланс различных процессов, в том числе химических реакций. Второй закон позволяет предсказать, при каких условиях процесс возможен и каким будет его результат при заданных условиях. Существуют несколько эквивалентных формулировок этого закона; для практического использования удобна следующая:
□ Существует экстенсивная функция состояния термодинамической системы - энтропия (S). При протекании в изолированной системе обратимых процессов эта функция остается неизменной, а при необратимых -увеличивается
dS(U,V,n) 01
01
Из этого следует, что после завершения релаксационных процессов при состоянии термодинамического равновесия энтропия изолированной системы достигает своего максимума:
d
S(U,V,n)![]() 0
d
2
S<0,
0
d
2
S<0,
Размерность энтропии - [энергия/температура = Дж-КГ ], в справочных изданиях приводятся мольные величины [Дж-моль" -К" ].
Понятие энтропии было введено в термодинамику Р. Клаузиусом. Неравенство Кпаузиуса связывает изменение энтропии с количеством
n = (n1, • n2, nN,) - набор количеств веществ.
dS 0
0
где знак равенства имеет место при обратимых, а неравенства - при необратимых процессах.
Источником
необратимого процесса может быть
диффузия, расширение системы при
существовании разности давлений между
ней и окружающей средой, теплопередача
при разных температурах, самопроизвольные
химические реакции в объеме системы и
другие диссипатпивные
процессы, связанные
с необратимым превращением работы в
теплоту. Неравенство выполняется
независимо от причины возникновения
необратимого процесса, более того, его
итог всегда предсказуем - это выделение
внутри системы дополнительного количества
теплоты. Р. Клаузиус назвал эту теплоту,
вызванную неравновесными процессами
в системе, некомпенсированной
теплотой
(![]() ).
Так как всегда (
).
Так как всегда (![]() ).,
и именно ее влиянием на рост энтропии
объясняется знак неравенства в, то при
изотермических процессах можно записать
это выражение в виде равенства:
).,
и именно ее влиянием на рост энтропии
объясняется знак неравенства в, то при
изотермических процессах можно записать
это выражение в виде равенства:
dS=(![]() )/T
)/T
dS = deS + diS
где
deS
= ![]() -
изменение энтропии, вызванное равновесным
теплообменом с окружением, diS
=
-
изменение энтропии, вызванное равновесным
теплообменом с окружением, diS
= ![]() 0
- рост энтропии из-за необратимых
процессов в системе, если они происходят1.
0
- рост энтропии из-за необратимых
процессов в системе, если они происходят1.
Подставляя выражение (4.3) в (2.2), получаем обобщенную форму записи первого и второго законов термодинамики:
dU=
TdS-pdV+![]()
dS
= -![]() dU
+
dU
+ ![]() dV-
dV-![]() .
.
Это
фундаментальные
уравнения Гиббса ;
из них следует, что частные производные
энтропии по экстенсивным переменным
U,
V
и
![]() выражаются
через интенсивные свойства системы:
выражаются
через интенсивные свойства системы:
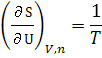
1 Индексы «е» и «i» - сокращение от «external» и «internal»
Расчет изменений энтропии при физических процессах
Изменение
энтропии при нагревании (охлаждении)
n
молей вещества от Т1
до Т2
при постоянном объеме или постоянном
давлении определяют по уравнениям:![]()
 ;
;
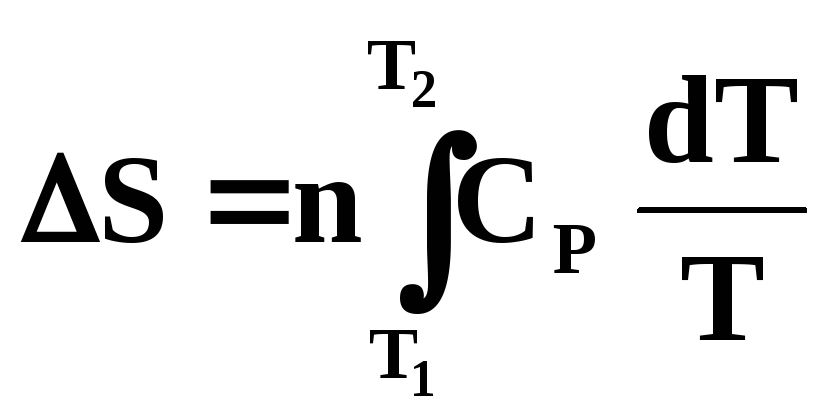 ,
,
где СV и СP – мольные изохорная и изобарная теплоемкости.
Для узкого интервала температур (Т1 – Т2) можно принять С = const. Тогда
![]()
![]() .
.
При точных расчетах необходимо учитывать зависимость теплоемкостей веществ от температуры и проводить соответствующее интегрирование.
Изменение энтропии при изотермическом (Т = const) расширении или сжатии n молей идеальных газов определяют по следующим формулам:
![]() ;
(1.34)
;
(1.34)
![]() ,
(1.35)
,
(1.35)
где V1 и V2 – мольные объема газа в первом и втором состоянии;
P1 и P2 – давления газа в первом и втором состоянии.
Изменение энтропии при фазовом переходе (Т = const, P = const) рассчитывается по формуле:
![]() ,
(1.36)
,
(1.36)
где ΔHф.п. и Тф.п. – изменение энтальпии (тепловой эффект) при фазовом переходе и температура фазового перехода, соответственно.
Энтропия – это величина аддитивная, поэтому энтропия всей системы равна сумме энтропий отдельных составляющих системы, а изменение энтропии в сложных процессах равно сумме изменений энтропии отдельных стадий. Это необходимо учитывать при расчете изменений энтропии в сложных системах и процессах. Например, если надо рассчитать изменение энтропии для системы, состоящей из одного вещества и претерпевшей нагревание, фазовый переход и расширение, то выполняется расчет изменений энтропии для отдельных стадий, а полученные результаты суммируются. При расчетах необходимо учитывать количество веществ в
