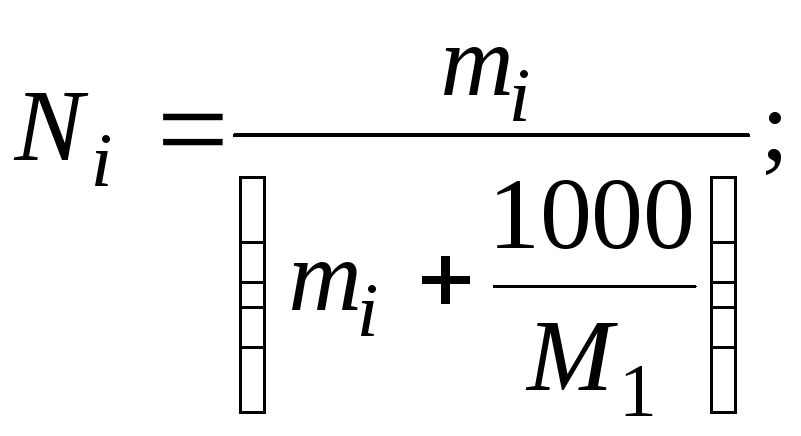- •Глава 9 трЕхкомпонентные системы
- •§ 9.1. Применение правила фаз Гиббса к
- •Трехкомпонентным системам
- •§ 9.2. Графическое изображение состава трехкомпонентных систем
- •Физ.Хим.Лекц.Веч.72.Ч. Тема № 5 (10 часов)
- •Раздел 2
- •§ 5.2. Концентрация растворов
- •§ 5.3. Молекулярная структура растворов. Межмолекулярные взаимодействия в растворах.
- •§ 5.4. Термодинамические условия образования растворов
- •§ 5.5. Парциальные молярные величины
- •§ 5.6. Давление насыщенного пара идеальных растворов. Закон Рауля
- •§ 5.7. Закон Генри. Растворимость газов в жидкостях
- •§ 5.8. Разбавленные растворы нелетучих веществ. Повышение температуры кипения и понижение температуры замерзания растворов
- •§ 5.9. Осмотическое давление растворов
- •§ 5.10. Давление насыщенного пара над раствором летучих компонентов
- •§ 5.11. Распределение вещества между двумя несмешивающимися жидкостями. Закон распределения
- •§ 5.12. Экстракция
§ 5.2. Концентрация растворов
Важной характеристикой раствора является его состав или концентрация компонентов. Для выражения концентраций раствора применяются различные способы. Мы в основном будем пользоваться следующими:
1. Молярность (ci) – это количество молей растворённого вещества в одном литре раствора
|
|
|
(5.1) |
2. Моляльность (mi) – количество молей растворённого вещества, приходящееся на 1000 г растворителя
|
|
|
(5.2) |
3. Мольная (молярная) доля (Ni) – отношение количества молей данного компонента к общему количеству молей всех компонентов в растворе
|
|
|
(5.3) | ||
|
где |
ni Σni V g |
– – – – |
количество данного вещества, моль; общее количество вещества в растворе; объём раствора, л; масса растворителя, г. | |
В физико-химических исследованиях концентрации компонентов раствора чаще выражают через мольные доли или через моляльности. Это связано с тем, что объём раствора, в том числе зависит и от температуры, т. е. с изменением температуры меняется и молярная концентрация раствора. Связь между мольной долей и моляльностью выражается следующим соотношением
|
|
|
(5.4) | ||
|
где |
М1 |
– |
Молекулярная масса растворителя (условимся растворитель помечать индексом 1, а растворённое вещество индексом 2). | |
§ 5.3. Молекулярная структура растворов. Межмолекулярные взаимодействия в растворах.
Жидкости и жидкие растворыобладают элементами кристаллической структуры: они имеют промежуточную структуру между газом и твердым веществом (в газах молекулы расположены хаотично, в кристаллах – на определённых расстояниях друг от друга в узлах кристаллической решётки). Молекулы в жидкости, как и в газе, находятся в хаотическом тепловом движении. Каждая молекула окружена другими молекулами, находящимися в среднем во времени, на некоторых преимущественных расстояниях от нее. Для более удаленных молекул эти преимущественные расстояния постепенно исчезают. Поэтому в жидкостях сохраняется так называемый ближний порядок в расположении молекул, который имеет статистический характер.
Между молекулами (атомами, ионами) в жидкости и растворе действуют физические (ван-дер-ваальсовы) и химические силы. Под действием химических сил в растворе образуются соединения разной прочности. Так, например, Д.И. Менделеев по измерению удельного веса растворов спирта в воде доказал существование в растворе нескольких соединений спирта с водой.
В XIX в. развивались две крайние теории растворов: химическая, в которой все свойства растворов пытались объяснить образованием в них различных химических соединений (Д.И.Менделеев и др.), и физическая, в которой растворенное вещество рассматривалось как газ, который заполняет инертный растворитель (Вант-Гофф, Аррениус и др.). В современной теории растворов признается важность как физических, так и химических сил между молекулами (атомами, ионами) в растворе.
В процессе растворения ионного кристаллического вещества в воде происходит сближение ионов с дипольными молекулами воды. При этом около каждого иона образуется слой тесно связанных с ионом молекул растворителя. Взаимодействие между молекулами растворителя и растворяющегося вещества называется сольватацией. Если растворителем служит вода, то сольватацию называют гидратацией. Совокупность молекул растворителя, окружающих ион, представляет собой сольватную оболочку. Первичной сольватной оболочкой называют воздействие иона на ближайшие молекулы растворителя, которые при этом теряют независимое движение и перемещаются вместе с ионом. Воздействие иона на более удаленные молекулы растворителя, влияющее на структуру растворителя в целом и на макроскопические свойства раствора, называется вторичной сольватной оболочкой.