§ 3.8. Влияние давления на химическое равновесие
Для
характеристики обратимых реакций,
идущих в газовой фазе, пользуются
константами K°,
KP,
KC,
KN,
Kf.
Значения K°,
KP,
KC,
Kf
не зависят от давления. В тоже время,
как было показано ранее
Логарифмируя
последнее соотношение, получаем
|
|

|
(3.61) |
Продифференцировав
это уравнение по давлению, и учитывая,
что KP
не зависит от давления, приходим к
уравнению, устанавливающему зависимость
константы KNот давления:
|
|

|
(3.62) |
Или,
воспользовавшись уравнением состояния
идеального газа P = (Δν / ΔV)·RT,
получим
|
|
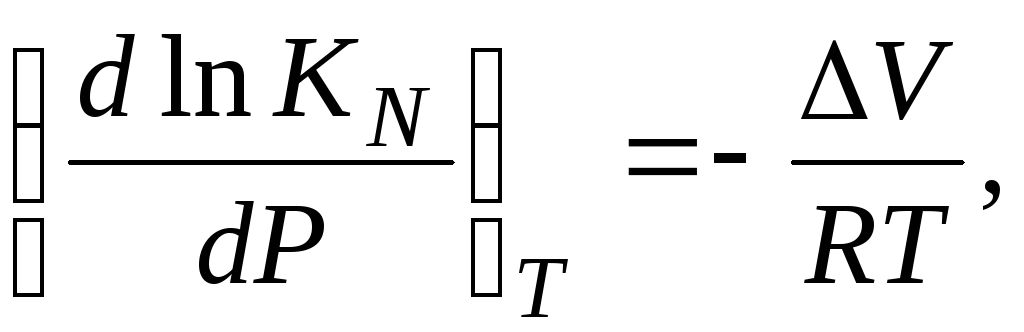
|
(3.63) |
|
где |
ΔV |
– |
изменение
объёма в результате реакции. |
Последние
два уравнения показывают, что константа
KN
не зависит от давления при Δν = 0
(ΔV = 0).
Если реакция идёт с уменьшением объёма
смеси (ΔV < 0)
и, соответственно, с уменьшением числа
молей реагирующих веществ (Δν < 0),
то константа равновесия возрастает, и
выход конечных продуктов увеличивается
с увеличением давления.
Если
объём системы возрастает в результате
реакции (ΔV > 0)
и, соответственно, увеличивается число
молей реагирующих веществ (Δν > 0),
то повышение давления вызывает уменьшение
константы равновесия и, соответственно,
количества получающихся продуктов
реакции.

