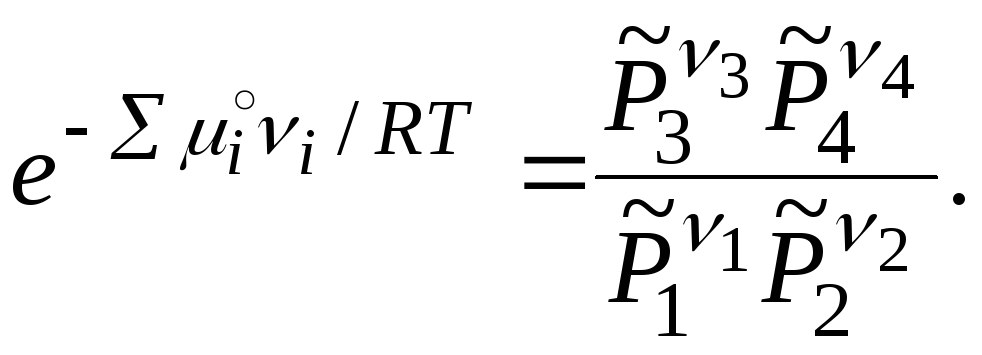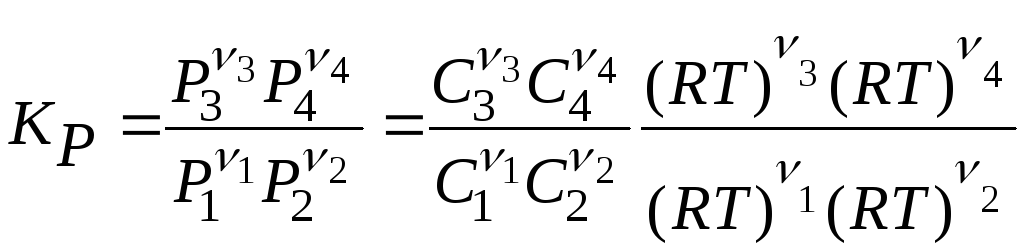- •Химическое равновесие
- •§ 3.1. Химический потенциал. Условия химического равновесия
- •§ 3.2. Химический потенциал идеального и реального газов. Фугитивность
- •§ 3.3. Закон действующих масс. Константа равновесия для гомогенных газофазных реакций
- •§ 3.4. Химическое равновесие в гетерогенных системах
- •§ 3.5. Расчёт состава равновесной смеси
- •§ 3.6. Уравнение изотермы реакции Химическое сродство.
- •§ 3.7. Влияние температуры на химическое равновесие
- •§ 3.8. Влияние давления на химическое равновесие
§ 3.3. Закон действующих масс. Константа равновесия для гомогенных газофазных реакций
Допустим, что между газообразными веществами А1, А2, А3, А4протекает химически обратимая реакция по уравнению
|
|
|
|
Химическая реакция протекает самопроизвольно до тех пор, пока не наступит химическое равновесие между реагирующими веществами. Химическое равновесие является динамическим равновесием, при котором скорости прямой и обратной реакции равны друг другу.
Состояние химического равновесия определяется двумя признаками:
если система находится в состоянии равновесия, то состав её с течением времени при постоянных внешних условиях не изменяется;
если система, находящаяся в равновесии, будет выведена из этого состояния вследствие внешних воздействий, то с прекращением их действия она возвратится к прежнему состоянию.
При установлении химического равновесия согласно уравнениям (3.6) и (3.12)
|
|
|
(3.26) | ||
|
где |
|
– |
относительное парциальное давление i-го индивидуального вещества в системе в момент установления равновесия. | |
Отсюда
|
|
|
(3.27) |
В выражении суммы слагаемые для исходных веществ должны быть взяты со знаком «–», а для продуктов реакции – со знаком «+». При потенцировании уравнения (3.27) получаем
|
|
|
(3.28) |
Так
как ![]() (стандартный химический потенциал)
зависит только от природы i-го
индивидуального реагента и температуры,
то при T = const
левая часть в уравнении (3.28)
является постоянной величиной и
называется стандартной константой
равновесия реакции K°:
(стандартный химический потенциал)
зависит только от природы i-го
индивидуального реагента и температуры,
то при T = const
левая часть в уравнении (3.28)
является постоянной величиной и
называется стандартной константой
равновесия реакции K°:
|
|
|
(3.29) |
Стандартная константа равновесия согласно уравнению (3.29) является безразмерной величиной. Если составные части реакционной смеси подчиняются законам идеального газа, то в соответствии с (3.28) и (3.29)
|
|
|
(3.30) |
Уравнение (3.30) называется законом действующих масс. Отношение произведения равновесных парциальных давлений (или концентраций) продуктов реакции, взятых в степенях, равных их стехиометрическим коэффициентам, к аналогичному произведению для исходных веществ при данной температуре есть величина постоянная (т. е. зависит только от природы веществ и температуры, и не зависит от общего давления).
Этот закон был выведен впервые из кинетических представлений Гульдбергом и Вааге (1867), а термодинамический вывод его был дан Вант-Гоффом (1885).
Уравнение (3.30) справедливо только для идеальных газообразных систем. Для расчета химического равновесия в реальных системах его можно использовать только при невысоких давлениях.
Если исходить из уравнения
|
|
|
(3.31) |
то совершенно таким же путём, как и при выводе уравнения (3.30) можно доказать закон действующих масс в виде
|
|
|
(3.32) | ||
|
где |
KN |
– |
константа равновесия, выраженная через мольные доли в момент равновесия. | |
Так
как ![]() в уравнении (3.31)
зависит от температуры и давления, то
KN = f(T,P).
в уравнении (3.31)
зависит от температуры и давления, то
KN = f(T,P).
Закон действующих масс нередко записывается ещё в двух формах для газообразных реакций:
|
|
|
(3.33) |
и
|
|
|
(3.34) | ||
|
где |
Pi Сi |
– |
парциальное давление; концентрация i-го реагента в момент равновесия, моль/л. | |
Константы KP и KC называются эмпирическими, поскольку в них используются определяемые на опыте значения Pi и Сi. Форма записи (3.33) и (3.34) закона действующих масс может быть непосредственно получена из уравнений кинетики обратимых реакций (метод Гульдберга – Вааге).
Взаимосвязь между константами KN, KP и KC выражается следующим соотношением
|
|
|
(3.35) | ||
|
где |
Δν = (ν3 + ν4) – (ν1 + ν2)
P |
–
– |
изменение числа молей газообразных веществ в ходе реакции; общее давление. | |
Для вывода этого соотношения разделим на V обе части уравнения Менделеева – Клапейрона, справедливого для каждого из реагентов идеальной газовой смеси
|
|
|
|
Получим
|
|
|
| ||
|
где |
Ci = ni/V |
– |
концентрация вещества в моль/л. | |
Подставив значения парциального давления каждого из реагентов, найденные по этой формуле, в уравнение (3.33), получим
|
|
|
|
и после упрощений:
|
|
|
|
Учитывая, что парциальное давление i-го компонента пропорционально его мольной доле
|
|
|
|
и подставляя это уравнение в (3.33), получаем
|
|
|
|
или
|
|
|
|
Используя соотношения
|
|
|
|
легко вывести уравнения, связывающие стандартную константу равновесия K° с константами KN, KP и KC.
|
|
|
(3.36) (3.37) (3.38) |
Как видно из уравнений (3.35) – (3.38) при Δν = 0 значения констант равновесия совпадают. В этом случае для определения константы равновесия можно вместо концентраций или давлений использовать пропорциональные им величины, например, число молей реагирующих веществ, объёмные проценты и т. п.
Если реакция протекает в смеси реальных газов, то в уравнение закона действующих масс вместо парциальных давлений входят соответствующие равновесные фугитивности (летучести)
|
|
|
(3.39) |
и
|
|
|
(3.40) |
Для химической реакции, протекающей в идеальном растворе, константу равновесия чаще всего выражают через мольные доли или молярные концентрации аналогично уравнениям (3.32) и (3.34). В случае неидеального (реального) раствора вместо концентраций используют соответствующие активности
|
|
|
(3.41) |
Ещё раз обратим внимание на то, что константы равновесия зависят от природы реагирующих веществ, температуры и не зависят от концентрации (KC, KN), давления (K°, KP), активности (Ka), фугитивности (Kf). Это не значит, что состав равновесной смеси является строго определённым. При изменении концентрации, давления, активности или фугитивности одного компонента аналогичные параметры для всех других компонентов будут изменяться, но таким образом, чтобы соответствующие константы равновесия оставались неизменными. Все представленные записи закона действующих масс могут быть использованы при расчёте состава равновесной смеси, но только одна из констант K° вычисляется по соответствующим значениям ΔG° или ΔH° и ΔS°.
Так как константы равновесия K°, KN, Ka, Kf выражаются через относительные величины, то они не имеют размерности. Константы равновесия KC и KP безразмерны только для реакций, идущих без изменения числа молей газообразных участников реакции. В остальных случаях KP имеет размерность давления в степени Δν, а KC – размерность концентрации в степени Δν.
|
|
[KP] = [давление]Δν; [KC] = [молярность] Δν. |
|
Следует отметить, что значение константы равновесия для данной реакции зависят от способа написания её уравнения. Например, для реакции, протекающей в газовой фазе:
|
|
|
|
Эта же химическая реакция может быть записана следующим образом:
|
|
|
|
то есть
|
|
|
|