
физ химия / новая папка Савельев / Новая папка / лекция 6
.docМаксимальная полезная работа
как мера химического сродства
Изотерма химической реакции
Константы равновесия определяют условия равновесия, когда концентрации (парциальные давления) являются равновесными. Рассмотрим, например, реакцию Н2 +I2 ↔ 2НI. Совсем не очевидно, в каком направлении пойдет эта реакция при Т = 298,15 К, когда парциальные давления исходных веществ и продуктов реакции отличаются от равновесных.
Ответить на этот вопрос поможет уравнение изотермы химической реакции, или, сокращенно, изотерма химической реакции.
Обозначим
в общем виде неравновесные парциальные
давления реагирующих веществ в
соответствии со схемой химической
реакции![]() ,
в виде
,
в виде![]()
Для изобарно-изотермического процесса в соответствии с (5.4) можно записать
 6.1
6.1
Используя равенство (5.14) и преобразования, аналогичные (5.15)-(5.17), получим
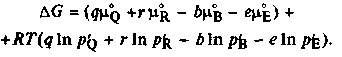 6.2
6.2
Первое
слагаемое правой части уравнения
согласно (5.18) равно
![]() второе
слагаемое равно
второе
слагаемое равно

т.е.

Изменение энергии Гиббса, определяемое условием (6.1), в отсутствие равновесия равно
 6.3
6.3
По аналогии с (6.3) и с учетом выражения для константы равновесия Кс получим
 6.4
6.4
Уравнения (6.3) и (6.4) есть уравнения изотермы химической реакции, первое - для изобарно-изотермического процесса, второе - для изохорно-изотермического
Химическая переменная и химическое сродство
После рассмотрения условий равновесия, которые определяют при помощи констант равновесия и отклонения равновесия, характеризующихся изотермой химической реакции, обратимся к еще одной возможности выразить особенности протекания химической реакции. Речь идет о химической переменной и химическом сродстве.
В любой химической реакции происходит изменение состава системы, который определяется температурой, давлением или концентрацией компонентов. Глубину протекания химической реакции можно выразить с помощью одной переменной, что позволяет строже и проще количественно представить термодинамические параметры. Покажем это на примере реакции получения воды
![]()

В общем виде можно записать
![]()
Знак "минус" - для исходных веществ, знак "плюс" - для продуктов реакции. Величина ξ есть химическая переменная.
Химическая переменная - отношение изменения числа молей компонента в химической реакции к его стехиометрическому коэффициенту, которое одинаково для всех компонентов и характеризует полноту реакции (иначе - число пробегов или координату реакции). Химическая переменная равна нулю в начале реакции и становится равной единице в том случае, когда все исходные вещества превратятся в продукты реакции.
Таким образом, в пределах одного пробега химическая переменная может принимать значения от 0 до 1
Химическое сродство характеризует отклонение системы от состояния химического равновесия. По аналогии с условием (5.11) химическое сродство (М) можно представить в виде

При М > О неравновесное состояние характеризуется избытком исходных веществ, и для достижения равновесия реакция должна идти слева направо. Когда М < О, реакция идет в противоположном направлении.
Химическое сродство представляется в виде частной производной по химической переменной любого термодинамического потенциала, в частности энергии Гиббса, а именно
![]()
В
этом выражении член
![]() заменяет
сумму многих параметров
заменяет
сумму многих параметров
 используемую
в традиционном (гиббсовском) описании
процесса.
используемую
в традиционном (гиббсовском) описании
процесса.
Химическое
сродство можно выразить в стандартных
условиях. Для этого обратимся к уравнениям
изотермы химической реакции (6.3) и (6.4).
Для газов при давлении, равном атмосферному,
когда
![]() =
1 атм первое слагаемое правой части
уравнения (6.3) равно нулю (1n1
= 0), т. е
=
1 атм первое слагаемое правой части
уравнения (6.3) равно нулю (1n1
= 0), т. е
![]() 6.5
6.5
где М °, ΔG ° - стандартное химическое сродство и изменение энергии Гиббса, когда Т= 298,15 К, а давление равно атмосферному
В соответствии с условием
ΔG = -W'макс (максимальная работа в изобарно-изотермическом процессе равна обратному по знаку изменению энергии Гиббса)
химическое сродство в стандартных условиях равно максимальной работе изобарно - изотермического процесса:
![]()
По аналогии химическое сродство для изохорно-изотермического процесса можно выразить через энергию Гиббса-Гельмгольца
![]() 6.6
6.6
Соответственно максимальная работа равна
![]()
В формулах (6.5) и (6.6) М° есть химическое сродство в стандартных условиях, характеризующее способность веществ вступать в химическую реакцию
Используя формулы эти формулы, можно по величине химического сродства определить константы равновесия, а именно
![]()
Уравнения изобары и изохоры химических реакций
Константы равновесия есть величины постоянные при данной температуре. При изменении температуры константа равновесия изменяется и довольно существенно. Одновременно с изменением константы равновесия в соответствии с уравнением (6.5) изменяется химическое сродство ΔG °(М°).
Изменения константы равновесия и направления химической реакции в зависимости от температуры количественно характеризуют уравнения изобары и изохоры химических реакций.
Выведем уравнение изобары химической реакции; обратимся к уравнению (6.3) и перепишем его в виде
 6.7
6.7
Продифференцируем это уравнение по Т и перепишем его
 6.8
6.8
Выражение в квадратных скобках, согласно (6.7), есть ΔG/Т, тогда вместо (6.8) получим
 6.9
6.9
Представим уравнение Гиббса-Гельмгольца в виде
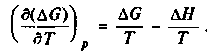 6.10
6.10
Из уравнения (6.9) вычтем уравнение (6.10) и получим

Уравнение изобары химической реакции в дифференциальной форме, т. е. при постоянном давлении и соблюдении условия δq=dH, выглядит следующим образом
 6.11
6.11
По аналогии с уравнением изобары уравнение изохоры в дифференциальном виде можно представить как
 6.12
6.12
Уравнение (6.12) показывает изменение константы равнове сия в зависимости от температуры в изохорных процессах, когда выполняется условие (δq=du) - в изохорно-изотермических процессах теплота процесса равна изменению внутренней энергии.
При помощи уравнений изобары и изохоры можно не только определить изменение констант равновесия и самого равновесия в зависимости от температуры, но и найти тепловой эффект химической реакции. Для этого необходимо уравнение изобары (6.11) выразить в интегральной форме; разделив переменные, получим
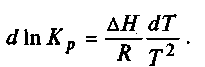 6.13
6.13
Интегрирование проведем для двух случаев. Первый - когда ΔН = const; тогда после интегрирования имеем
![]() 6.14
6.14

Во втором случае, когда ΔН≠const, интегрирование уравнения (6.13) дает следующие результаты
![]() 6.15
6.15
Определение констант равновесия хим. реакций
Можно выделить два метода определения константы хим. реакции:
- 1 й метод ЭКСПЕРИМЕНТАЛЬНЫЙ, который основан на законе действующих масс:
![]()
- 2 метод ТЕОРЕТИЧЕСКИЙ, который основан на применении изотермы Вант-Гоффа

ΔG°=ΔH°-TΔS°
![]()
1-й метод Расчет равновесия хим. реакции по известной константе равновесия
Этот метод основан на применении ЗДМ, при этом конц-ция одного з реагентов обозначается через х. Зная соотношения, в которых реагируют вещ-ва, можно через эту величину выразить конц-цию остальных реагентов. Затем составляется и решается математическое уравнение, в результате которого находится х и все остальные концентрации.
ксерокопия
2-й метод Метод Темкина -Шварцмана
Для практических целей приходится константу равновесия вычислять при температурах более высоких, чем стандартная. Для этого необходимо знать ΔGT°, ΔHT°, ΔST° Значительные сокращения математических операций при подсчете указанных величин достигаются методом, предложенным М. И. Темкиным и Л. А. Шварцманом.
Как уже писали, зависимость теплового эффекта химич. реакции от температуры выражается уравнением:
dΔH°/dT=ΔCp°
В интегральной форме это уравнение будет выглядеть:
 6.16
6.16
Уравнение для расчета изменения энтропии химич. реакции в интегральной форме выглядит как:
 6.17
6.17
Значения 6.16 и 6.17 подставляем в уравнение ΔG°=ΔH°-TΔS°, получим:
 6.18
6.18
После подстановки в подынтегральные выражения степенного ряда
![]()
получим:
 6.19
6.19
Проинтегрировав это уравнение, приходим к следующему:
 6.20
6.20
Раскроем скобки и сгруппируем члены относительно температурных коэффициентов
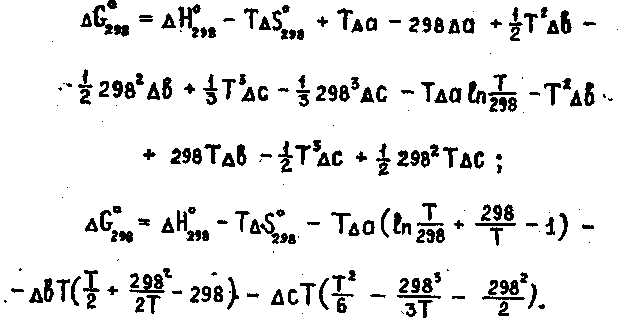 6.21
6.21
Обозначим:
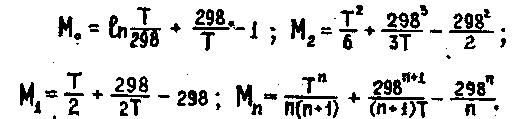

Подставив в уравнение 6.21 значение М1 , получим:
 6.22
6.22
Выражение для Мn справедливо, начиная с М1. Коэффициенты М0 ... Мn зависят только от температуры. Они рассчитаны и представлены в справочной литературе. Полученное значение ΔG°т, подставив в уравнение lnKp=-ΔGT°/RT, получим значение константы равновесия для температуры выше стандартной.
