
Глава 7 однокомпонентные системы
§ 7.1. Применение правила фаз Гиббса к
Однокомпонентным системам
Для однокомпонентной системы, на равновесие которой из внешних факторов оказывают влияние только давление и температура, правило фаз Гиббса выражается уравнением
|
|
|
(7.1) |
Следовательно, в однокомпонентной системе число фаз, одновременно находящихся в равновесии, не может быть больше трёх.Однако это не означает, что в данной однокомпонентной системе могут образоваться лишь три фазы. Речь идет о том, что в однокомпонентных системах совместно не могут существовать более трёх равновесных фаз. В зависимости от числа фаз, находящихся в равновесии, однокомпонентные системы могут быть дивариантными (Ф = 1, С = 2), моновариантными (Ф = 2, С = 1) и инвариантными (Ф = 3, С = 0).
Особо следует остановиться на неравновесных метастабильных фазах, к которым правило фаз неприменимо. Примером метастабильной фазы может служить перегретая или переохлажденная вода (переохлаждённая вода является неустойчивой и кристаллизуется в присутствии кристаллика льда; перегретая вода испаряется в присутствии пара).
§ 7.2. Фазовые переходы первого и второго рода
Согласно Эренфесту, фазовый переход первого рода – это равновесный переход вещества из одной фазы в другую, в котором скачкообразно изменяются первые производные от энергии Гиббса G по температуре и давлению. Следовательно, при фазовом переходе первого рода скачкообразно изменяются такие свойства системы, как энтропия S и объём V (рис. 7.1), так как
|
|
|
|
(см. § 2.7).
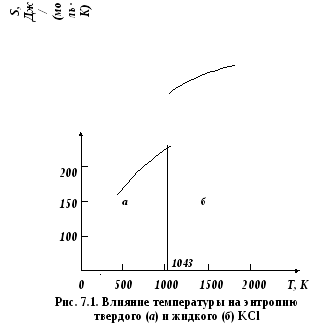
При фазовых переходах первого рода скачкообразно могут изменяться и вторые производные от энергии Гиббса. В системах с фазовыми переходами первого рода энергии Гиббса каждой из фаз (GI и GII) являются различными функциями термодинамических параметров. Зависимости GI и GII от температуры в таких системах показаны на рис. 7.2. Кривые GI = f(T) и GII = f(T) пересекаются при температуре фазового перехода Тф.п., при которой GI = GII и dG = 0. При T < Тф.п. устойчивой является фаза (I), так как GI < GII, а при T > Тф.п. – фаза (II), так как GII < GI.

В системах с фазовыми переходами первого рода имеется возможность существования метастабильных состояний, например переохлаждения или перегрева фаз, которые наблюдаются иногда при медленном переходе через температуру Тф.п.. Примерами фазовых переходов первого рода служат взаимные переходы между твёрдыми, жидкими и газообразными фазами вещества (плавление – кристаллизация, кипение – конденсация, сублимация – конденсация, аллотропические превращения: переход одной твёрдой фазы в другую).
Фазовый переход второго рода – это равновесный переход вещества из одной фазы в другую, в котором скачкообразно изменяются только вторые производные от энергии Гиббса по температуре и давлению. Следовательно, при фазовом переходе второго рода скачкообразно изменяются только теплоёмкость СР, коэффициент объёмного расширения α и сжимаемость β:
|
|
|
|
При фазовом переходе второго рода энергия Гиббса изменяется непрерывно с изменением термодинамических параметров. Зависимость энергии Гиббса от температуры показана на рис. 7.3.
При фазовых переходах второго рода непрерывно изменяются и первые производные от энергии Гиббса по температуре и давлению, т. е. энтропия и объём. В системах с фазовыми переходами второго рода невозможно существование метастабильных состояний, и каждая фаза может существовать только в определённой температурной области.
Примерами
фазовых переходов второго рода являются
переходы жидкого г елия
в сверхтекучее состояние, железа из
ферромагнитного в парамагнитное
состояние, металла из обычного в
сверхпроводящее состояние, переход
«порядок – беспорядок» в сплавах
типаβ-латуни
и др.
елия
в сверхтекучее состояние, железа из
ферромагнитного в парамагнитное
состояние, металла из обычного в
сверхпроводящее состояние, переход
«порядок – беспорядок» в сплавах
типаβ-латуни
и др.
