
- •1. Гальванические элементы
- •1.2. Правило записи гальванических элементов.
- •1.3. Уравнение Нернста для расчета потенциалов электродов.
- •1.4. Уравнение Нернста для расчета электродвижущей силы
- •1.5. Термодинамика гальванического элемента.
- •1.6. Классификация электродов.
- •1.6.2. Электроды второго рода
- •1.6.3. Газовые электроды.
- •1.6.4. Окислительно-восстановительные электроды.
- •1.6.5. Ионно-селективные электроды.
- •2. Экспериментальная часть.
- •2.1. Содержание работы.
- •2.2. Порядок выполнения работы.
- •2.2.1. Определение потенциалов отдельных электродов.
- •2.2.2. Определение эдс гальванических элементов.
- •3 Контрольные вопросы.
1. Гальванические элементы
Источники электрического тока, в которых электрическая энергия получается за счет энергии химической реакции, называются гальваническими элементами.Гальванический элемент состоит из положительного и отрицательного электродов. Электрод представляет собой электрохимическую систему, состоящюю из двух фаз. На
Гальванические элементы– это устройства, позволяющие получать постоянный электрический ток за счет окислительно-восстановительных химических реакций.
Гальванический элемент состоит из двух электродов с различными электрическими потенциалами, возникающими на границе раздела фаз.
В зависимости от характера и природы соприкасающихся сред различают константный потенциал, диффузионный потенциал и потенциал на границе раздела твердой и жидкой фаз.
Контактная разностьпотенциалов возникает на границе соприкосновения двух разнородных металлов за счет перехода электронов из одного металла в другой.
Диффузионная разностьпотенциалов (диффузионный потенциал) возникает на границе соприкосновения двух растворов, отличающихся концентрацией или природой растворимого вещества, за счет перехода ионов из одного раствора в другой.
Величины контактного и диффузионного потенциалов невелики (не превышают нескольких сотых вольта), поэтому в гальванических элементах при получении электрического тока за счет химических реакций они не имеют практического значения.
При проведении окислительно-восстановительных реакций в растворе происходит переход электронов от одних частиц к другим, и этот процесс движения электронов носит хаотический характер.
Постоянный электрический ток в виде направленного движения электронов по металлическим проводникам за счет химической реакции может быть получен при разделении процессов окисления и восстановления в пространстве, что и осуществляется в гальваническом элементе.
При этом практическое значение имеет возникновение разности потенциалов на границе твердой (металл) и жидкой фазы.
Металлическое тело состоит из ионов металла, образующих кристаллическую решетку, и относительно свободных электронов, заполняющих промежутки между ионами. При соприкосновении металла с раствором, содержащим его собственные ионы, между поверхностью металла и раствором происходит обмен ионами металлов. Преимущественный переход ионов металлов в раствор или ионов раствора в металл определяется величинами химических потенциалов катионов металла в твердой фазе (Мтв.) и катионов металла в растворе (Мж.).
Если Мтв>Мж, то катионы переходят из металла в раствор до тех пор, пока не выровняются их химические потенциалы. При этом поверхность металла заряжается отрицательно, а раствор, прилегающий к поверхности металла – положительно.
Если Мтв<Мж, то катионы из жидкой фазы переходят в твердую до наступления равновесия. При этом они присоединяют электроны, находящиеся в металле, в следствие чего поверхность металла приобретает положительный заряд, а раствор – отрицательный.
Электростатические силы притяжения, возникающие между заряженными поверхностями металлов и ионами противоположного знака в растворах, не дают последним удалиться от поверхности в глубь раствора. Таким образом, на границе раздела металл-раствор образуется так называемый двойной электрический слой, приводящий к возникновению разности электрических потенциалов.
Разность потенциалов, возникающая на границе раздела твердой и жидкой фаз, называется скачком потенциала.
В настоящей работе исследуются классические цинк- медный и калий медный элементы.
Рассмотрим процессы, протекающие на электродах цинк- медного гальванического элемента Якоби-Даниэля.
Если цинковую пластинку погрузить в водный раствор соли цинка (ZnSO4), то ионы цинка, находящиеся в поверхностном слое металла гидратируются полярными молекулами растворителя и переходят в раствор:
Zn ⇄ Zn2++2e- (14.1)
Поверхность металлического цинка в следствии протекания этой электродной реакции заряжается отрицательно, а поверхность раствора, прилегающего к металлу – положительно. Возникающая разность потенциалов между металлом и раствором определяет величину скачка потенциал:
Zn2+/Zn=1-2, (14.2)
где 1 и 2 – потенциалы металла и раствора.
При некотором значении этого потенциала дальнейшее растворение катионов становится невозможным в следствие электростатического притяжения катионов к отрицательно заряженной пластине. В этом случае устанавливается равновесие между твердой и жидкой фазой, а потенциал, при котором это происходит, называется равновесным.
Электрическое поле, создаваемое поверхностью заряженного металла, вызывает неравномерное распределение ионов в растворе. Отрицательно заряженная поверхность металла притягивает катионы, и концентрация их в слое, непосредственно прилегающем к поверхности металла, является повышенной (плотный адсорбционный слой).
В растворе, по мере удаления от поверхности металла, концентрация катионов уменьшается, и они располагаются в виде размытого за счет теплового движения диффузионного слоя.
Строение двойного электрического слоя на границе металл-раствор представлено на рис. 14.1.(а).

Рис. 14.1. Строение двойного электрического слоя на границе металл-раствор.
Если медную пластинку поместить в водный раствор ее соли (CuSO4), то ионы меди будут разряжаться на ней, так как химический потенциал катионов меди больше химического потенциала металлической меди (Мж>Мтв):
Cu2++2e⇆Cu (14.3).
В этом случае поверхность металлической пластинки зарядится положительно (1’), а раствор – отрицательно (2’). Образуется двойной электрический слой (рис. 14.1, б). Величина скачка потенциала на границе раздела фаз металл-раствор определяется соотношением:
![]() (14.4).
(14.4).
Абсолютные величины скачков потенциалов между фазами не поддаются экспериментальному определению. Их определяют по отношению к стандартному водородному электроду, потенциал которого принят равным нулю. Изменение электродного потенциала сводится к измерению электродвижущей силы (э.д.с.) гальванического элемента, составленного из изучаемого электрода и стандартного водородного электрода.
Если соединить электроды (полу элементы) с различными электрическими потенциалами металлическим проводником, то электроны будут перетекать с отрицательной пластинки к положительной до выравнивания электрических потенциалов. Чтобы процесс получения постоянного электрического тока происходил непрерывно электрохимическую цепь замыкают, соединяя растворы солей, в которые помещены соответствующие электроды, электрохимическим мостиком (сифонной трубкой, наполненной насыщенным раствором KCl илиNH4NO3, катионы и анионы которых имеют одинаковую подвижность:k++Cl-; NH4+=NO3-). Полученное устройство и будет представлять собойгальванический элемент. Схема рассмотренного гальванического элемента Якоби-Даниэля представлена на рис. 14.2
Zn R
(-)
(+)
Zn2+ Cu2+ ZnSO4 Cu 2 4 1 3 5 CuSO4


















































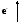




















Рис. 14.2 Схема цинк-медного гальванического элемента Якоби-Даниэля1 – цинковый электрод; 2 – медный электрод; 3 – сосуд с раствором ZnSO4; 4 – сосуд с растворомCuSO4; 5 – электрохимический мостик;R – сопротивление; А – амперметр.
Таким образом, при работе гальванического элемента Якоби-Даниэля на цинковом электроде протекает процесс окисления цинка:
Zn⇆Zn2++2e-, (14.5)
На медном электроне – процесс восстановления ионов меди:
Cu2++2e⇆Cu (14.6)
Эти процессы пространственно разделены. Суммарная химическая реакция, за счет которой получается электрический ток в гальваническом элементе, может быть представлена следующим образом:
Zn+Cu2+⇆Zn2++Cu (14.7)
Эта химическая окислительно-восстановительная реакция является гетерогенной, поэтому константа равновесия для нее может быть записана следующим образом:
 ,
(14.8)
,
(14.8)
где
![]() и
и
![]() - активности потенциалоопределяющих
ионовZn2+
и Cu2+
в растворах полу элементов.
- активности потенциалоопределяющих
ионовZn2+
и Cu2+
в растворах полу элементов.
Аналогично рассмотренному работает кадмий-медный гальванический элемент. Химические реакции, происходящие в этом элементе:
на кадмиевом электроде:
Cd⇆Cd2++2e; (14.9)
на медном электроде:
Cu2++2e⇆Cu; (14.10)
суммарная реакция:
Cd+Cu2+⇆Cd2++Cu (14.11)
Различают обратимые и необратимые электроды. При перемене направления электрического тока (за счет внешнего источника) на обратимых электродах протекают реакции, противоположные по направлению электродным процессам.
Электродвижущая сила (э.д.с.)гальванического элемента (Е) – это величина положительная и определяется как разность потенциалов положительного и отрицательного электродов:
Е=(+)-(-) (14.12)
Для рассмотренных гальванических элементов:
![]()
(14.13)
![]()
Наибольшая разность потенциалов достигается при термодинамически обратимых условиях работы ( при протекании тока бесконечно малой величины). При необратимом протекании процесса часть энергии химической реакции теряется, превращаясь в теплоту, а не электрическую работу.
