
Материаловедение(лекции)
.pdf
t, °С
B
Чистый |
0 |
|
|
a |
В |
а |
|
|
|
|
|
60% A |
|
1 Ж + |
|
b |
|
|
|
40% B |
|
|
|
|
2 b |
|
|
|
|
|
|
|
|
А |
|
Чистый |
|
Твердый раствор |
|
|
|
|
|
А |
|
3 |
|
|
|
||
|
|
|
|
0–1 |
1–2 |
2–3 |
|
Ж |
|
|
|
Рис. 11 |
|
Примером сплавов с такими диаграммами состояния являются сплавы системы Cu–Ni.
На диаграмме (рис. 11) присутствуют три области: область выше линии АаВ – жидкость; область между линиями АаВ и АbВ – жид$ кость и твердый раствор. Ниже лини АbB – область твердого раствора. Линия АаВ называется линией ликвидус; линия АbB называется ли$ нией солидус.
Кристаллизация любого сплава начинается выпадением из жид$ кого расплава отдельных кристаллов твердого раствора (например, в точке а ) и заканчивается полным затвердеванием твердого раство$ ра (например, в точке b ). Но так как в интервале кристаллизации сплавы находятся в двухфазном состоянии (Ж + ), то при пониже$ нии температуры должно изменяться соотношение количеств жид$ кой и твердой фазы в двухфазной области – количество жидкости уменьшается, а количество $твердого раствора растет. Кроме того, при понижении температуры будут меняться также составы жидкой и твердой фаз. Для определения относительного количества каждой фазы и состава фаз на диаграммах состояния любого типа пользуют$ ся правилом отрезков, основные положения которого формулиру$ ются следующим образом. Чтобы определить концентрации компо$ нентов в двухфазной области, через интересующую нас точку, харак$ теризующую состояние сплава, проводят горизонтальную линию до пересечения с линиями, ограничивающими двухфазную область.
21

Проекции точек пересечения на ось концентраций покажут состав жидкой и твердой фазы.
Чтобы определить количественное соотношение жидкой и твер$ дой фаз, необходимо составить обратно пропорциональную зави$ симость между их количеством и отрезками горизонтальной ли$ нии, образованными между точкой, характеризующей состояние сплава, и точками, определяющими состав жидкой и твердой фаз.
Рассмотрим на примере двух типов диаграмм (рис. 12, а и б) правило отрезковдляопределенияколичестваисоставафаз,напримервточкеk.
a) |
|
|
|
B |
б) |
|
B |
|
|
|
|
631 °C |
|
||
|
|
|
|
|
|
1452 °C |
|
|
|
|
|
|
|
|
|
|
l |
|
k |
s |
|
l |
k s |
327 °C |
A |
|
|
|
|
|
|
C |
|
245 °C |
1083 °C |
b |
|
||
|
|
|
|||||
|
D |
|
|
E |
A |
l |
s |
|
l |
|
|
|
|||
|
Pb 13 |
44 |
72% |
Sb |
Cu |
30 |
45 60% Ni |
Рис. 12
Для определения соотношения фаз и их состава через точку k про$ водим горизонтальную линию до пересечения с линиями, ограничи$ вающими двухфазную область на диаграмме (точки l и s, рис. 12). Проекции точек пересечения на ось концентраций показывают со$ став жидкой фазы (точка l проекция точки l, лежащей на линии лик$ видус) и твердой фазы (точка s проекция точки s). В соответствии с правилом отрезков горизонтальные линии между точкой k и точка$ ми, определяющими составы фаз, обратно пропорциональны коли$ чествам этих фаз, т. е. можно записать Qs sk = Ql lk ; Qs/Ql = lk/sk, где Qs, Ql – количество твердой и жидкой фаз соответственно.
Для определения отношения какой$либо фазы (твердой или жид$ кой) ко всему количеству сплава Qs+l используются выражения: Qs/Qs+l = lk/sl , Qs = Qs+l lk/sl, где sl – вся длина горизонтальной ли$ нии.
При охлаждении сплава в интервале кристаллизации состав жид$ кой фазы меняется в соответствии с правилом отрезков меняется по линии ликвидус, а твердой фазы – по линии солидус.
Правило отрезков можно использовать не только для изучения процесса кристаллизации сплавов, но и для рассмотрения процес$ сов, происходящих в твердом состоянии.
22

Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии (3 го рода)
Исходные данные: оба компонента неограниченно растворимы в жидком состоянии, ограниченно растворимы в твердом состоянии и не образуют химических соединений.
Компоненты: химические элементы А и В (K = 2).
Фазы: жидкость Ж, твердые растворы (раствор компонента А в В) и (раствор В в А) (Ф = 3).
На диаграмме (рис. 13) растворимость В в А не меняется с измене$ нием температуры, а растворимость А в В – меняется. Линия GCH – линия ликвидус, линия GEDH –линия солидус.
t |
A |
I |
II |
|
|
|
|||
|
|
0 |
|
0 |
|
|
1 |
|
1 |
|
|
|
2 |
|
|
|
|
|
2 |
|
|
|
|
3 |
Сплав I
Сплав IV
Сплав III
|
I |
II |
G |
|
|
|
1 |
|
|
Ж+ |
1 |
2 |
2 |
|
E |
2 |
|
|
|
Э+ |
|
|
|
3 |
3 |
3 |
A |
N |
|
0–1 |
|
1–2 |
|
Ж |
|
III |
|
IV |
|
Ж |
0 |
|
0 |
|
1 |
||
|
|
||
1 |
Ж+ |
|
|
C |
2 |
||
2 |
D |
|
|
|
|
||
Эвтектика |
|
|
|
) ( |
|
|
3 |
Э II
3 4
2–3
Ж
H +
II
F
B
III IV B
00
1
1
2
2
2
3
4
0–1 |
1–2 |
2–3 |
3–4 |
|
Ж |
|
|
|
|
|
|
II |
||
|
|
|
|
|
|
Ж |
|
|
|
0–1 |
1–2 |
2 –2 |
2–3 |
|
Ж |
|
|
|
|
|
|
|
|
II |
|
Ж |
|
|
Эвтектика |
|
|
Эвтектика |
( ) |
|
( )
Рис. 13
Врассматриваемой системе компонентыАи Внемогутпризатверде$ вании образовывать собственных кристаллов, так как они между собой образуют твердые растворы и в тех областях диаграммы, которые
23
расположены, соответственно, слева от вертикали EN и справа от ли$ нии DF.В этих областях все сплавы кристаллизуются в интервале меж$ ду ликвидусом и солидусом, так же, как этот процесс проходит в любом сплаве на диаграммах состояния 2$го рода. Соответственно в области, лежащей слева от линии EN, при кристаллизации из жидкости начи$ нают выделяться кристаллы твердого раствора (например, для спла$ ва Iв точке 1). В интервале кристаллизации сплавы имеют двухфазную структуру Ж+ . После завершения кристаллизации и вплоть до окон$ чательного охлаждения все эти сплавы имеют структуру однородного твердого раствора . Аналогичная ситуация имеет место у всех спла$ вов, расположенных справа от точки F, с той лишь разницей, что вмес$ то $твердогораствораунихвыделяютсякристаллы $твердогораствора.
Усплавов, расположенных винтервалемежду точкой Fипроекцией точки D, первичная кристаллизация в интервале между ликвидусом и солидусомпротекаетаналогичноописаннойранее.Приэтомтакиеспла$ вы после завершения кристаллизации, вплоть до пересечения с линией DFимеют однородную структуру $твердого раствора (например, сплав IV в интервале между точками 2 и 3). При дальнейшем охлаждении этих сплавов вплоть до полного охлаждения в их структуре происходят изменения,связанныесвыделениемиз твердогорастворавторойфазыII (например, у сплава IV), причиной появления которой является уменьшение предела растворимости $твердого раствора при снижении температурысплава.Наэтоуказываетнаклонный характеркривой DF. Припонижениитемпературытвердыйраствор становитсяпересыщен ным компонентом А, и для приведения системы в равновесие из этого твердого раствора в выделяется избыток растворенного компонента А. Но так как в рассматриваемой системе чистые компоненты не могут существовать как самостоятельные фазы (они должны образовывать твердые растворы), то на базе избыточных кристаллов компонента А образуется сразу же $твердый раствор, кристаллы которого и выделя$ ются из $твердого раствора и располагаются в виде мелкодисперсных включений внутри зерен основной фазы. Такие избыточные кристал$ лы, выделяющиеся не из жидкости, а из твердой фазы обозначаются II (вторичные $кристаллы), а сам процесс выделения новой фазы в твер$ дом состоянии называется вторичнойкристаллизацией.
Точки Е и N характеризуют предельную растворимость компонен$ та В в компоненте А, т. е. предельную растворимость $твердого ра$ створа при эвтектической и нормальной температурах, а точки D и F
– предельную растворимость компонента А в компоненте В, т. е. пре$ дельную растворимость $твердого раствора также при эвтектичес$ кой и комнатной температурах.
24
Точки E и D являются границами линии ED, в пределах которой протекает эвтектическое превращение, а точка С – эвтектической точкой. Следовательно, во всех сплавах, расположенных в пределах границ эвтектической линии, будет проходить эвтектическое превра$ щение, аналогичное тому, которое имеет место на диаграммах состо$ яния I$го рода с той лишь разницей, что в данном случае эвтектика состоит не из механической смеси компонентов А и В, а из механичес$ кой смеси их твердых растворов и . Соответственно, эвтектика в этом случае будет иметь вид Э ( + ), а эвтектическая реакция может быть записана так: Ж > E + D. Сплав с концентрацией компонентов А и В, соответствующих проекции точки С, т. е. сплав состава точки
С, называется эвтектическим.
Все сплавы, расположенные между точкамиСи Е, называются доэв тектическими.Ихкристаллизациябудетначинатьсясвыделениякри$ сталлов $твердого раствора (например, у сплава IIв точке 1). В интер$ вале кристаллизации (например, между точками 1 и 2) у этих сплавов будет двухфазная структура Ж+ . На линии EC(например, в точке 2) в доэвтектических сплавах будет проходить эвтектическая реакция у той части жидкости Ж, которая еще осталась в сплаве на этот момент (ее количество можно определить по правилу отрезков). Поэтому для доэвтектических сплавов правомерно будет записать эвтектическую ре$ акцию в следующем виде: + Ж > + Э ( + ).
Все сплавы, расположенные между точками С и D, называются заэвтектическими. Их кристаллизация будет начинаться с выделе$ ния кристаллов $твердого раствора (например, у сплава III в точке 1). В интервале кристаллизации (например, у сплава III между точками 1 и 2) эти сплавы имеют двухфазную структуру Ж + . На линии CD у заэвтектических сплавов будет проходить эвтектическая реакция, по$ добная реакции доэвтектических сплавов, т. е. + Ж > + Э ( + ). Но при дальнейшем охлаждении заэвтектических сплавов в их структре будут проходить последующие превращения, которых не было в до$ эвтектических сплавах. Причиной этих превращений является на$ клонный характер линии DF. При наклонном характере кривой ра$ створимости компонента А в компоненте В (линия DF) с понижением температуры предельная растворимость А в Встановится меньше того количества А, которое в данный момент присутствует в сплаве. По$ этому из твердого раствора будет выделяться II. Следовательно, все заэвтектические сплавы ниже температуры эвтектического пре$ вращения (например, сплав III ниже точки 2) будут иметь следую$ щую структуру: + Э ( + ) + II. Эта структура содержит три струк$ турных составляющих – , Э ( + ) и II, но при этом структура явля$ ется двухфазной: $фаза и $фаза.
25
Диаграмма состояния сплавов, испытывающих полиморфные превращения
Исходное состояние: оба компонента неограниченно растворимы в жидком состоянии, в твердом состоянии могут образовывать меха$ нические смеси в результате эвтектического или перитекгического превращения, а также могут образовывать непрерывные твердые ра$ створы и, кроме всего перечисленного, хотя бы один из компонентов обладает полиморфизмом.
Компоненты: химические элементы: А, В (K= 2). Фазы: жидкость Ж, твердые растворы , , .
При полиморфных превращениях в сплавах происходит перекри$ сталлизация существующих твердых фаз, которая подчиняется тем же закономерностям, которые определяют процесс кристаллизации из жидкого состояния.
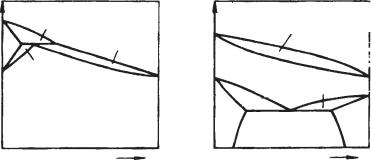
Если в сплавах один или оба компонента обладают полиморфиз$ мом, то и сами сплавы из этих компонентов претерпевают полиморф$ ные превращения в твердом состоянии. В этом случае диаграммы со$ стояния становятся «многоярусными», причем верхний ярус диаг$ раммы характеризует первичную кристаллизацию из жидкого состо$ яния, а нижняя часть – вторичную (перекристаллизацию), т. е. вы$ деление кристаллов новой твердой фазы из твердой первичной фазы, например кристаллов $твердого раствора из первичного $твердого раствора с другой кристаллической решеткой (рис. 14, а).
Вобщем случае вид рассматриваемой диаграммы зависит от того, какие фазы образуются в сплавах в процессе полиморфных превра$ щений. Всевозможных вариантов может быть много. Рассмотрим два наиболее характерных случая (рис. 14, а, б).
Впервом случае (рис. 14, а) компонент А имеет аллотропические
модификации А и А , которые образуют с компонентом В два твер$ дых раствора и . В результате сплавы до температуры, соответ$
ствующей точке С (температура полиморфного превращения), име$ ют либо однофазную структуру $твердого раствора, либо двухфаз$ ную структуру + твердого раствора. В этих сплавах при охлажде$
нии ниже температуры полиморфного превращения проходит поли$ морфное превращение с изменением кристаллической решетки.
Во втором случае (рис. 14, б) оба компонента испытывают поли$ морфные превращения, при этом низкотемпературные модификации их ограниченно растворимы друг в друге, а высокотемпературные – неограниченно. В нижнем ярусе диаграммы фактически представле$ на диаграмма 3$го рода, т. е. диаграмма с образованием твердых ра$ створов ограниченной растворимости и протеканием эвтектического
26
a) t |
A |
Ж+ |
Ж |
б) t |
A |
|
|
|
|
|
|
|
|
|
Ж+ |
|
|
|
|
F |
|
|
|
|
|
|
|
Ж+ |
|
|
|
|
|
||
А |
D |
|
|
|
|
|
||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
Ж |
|
|
|
|
|
|
А |
|
|
|
|
C |
|
|
B |
|
|
|
B |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
B |
|
|
|
|
|
|
|
E |
|
|
|
|
А |
|
|
D |
||
А |
|
|
|
C |
|
|
||
|
|
|
|
|
|
+ |
B |
|
|
|
|
B,% |
|
|
|
B,% |
|
Рис. 14
превращения. Однако отличительная черта данного эвтектического превращения состоит в том, что исходной фазой распада является не жидкость Ж, а твердый раствор , который при переходе через линию KCN распадается на два новых раствора и по реакции + .
Такое превращение, по сути аналогичное эвтектическому, но про$ исходящее в твердом состоянии, называется эвтектоидным, а по$ лученная механическая смесь – эвтектоидом. Сплав состава точки С называется эвтектоидным. Соответственно, сплавы, расположен$ ные слева от точки С (сплав эвтектоидного состава), называются до эвтектоидными, а справа от нее – заэвтектоидными.
3.3.Неравновесная кристаллизация
иперекристаллизация сплавов
Рассмотренные диаграммы состояний характеризуют равновес$ ное состояние сплавов, т. е. структуры, образующиеся при очень малых скоростях охлаждения, при которых успевает произойти диффузия, позволяющая выровнять переменный состав кристал$ лов твердой фазы.
Рассмотрим процесс неравновесной кристаллизации сплавов с нео$ граниченной растворимостью компонентов (рис. 15, а) и с ограни$ ченной растворимостью и эвтектическим превращением (рис. 15, б).
При равновесной кристаллизации из жидкой фазы выделяются кристаллы твердой фазы, состав которых соответствует определен$ ной точке, лежащей на линии солидус. Например, при температуре t1, твердого раствора , содержащего 50% компонента В, будет соот$ ветствовать точке k1; при температуре t2 состав кристаллов $твердо$ го раствора будет соответствовать точке n; при температуре t3 – точке n1 и при температуре t4 должна полностью завершиться кристалли$
27

a) t |
Ж |
|
|
|
б) |
t |
|
|
|
t1 |
|
Ж+ |
A |
||
|
|
|
|
|
|||
|
|
|
m |
|
k1 |
|
|
|
m |
|
|
t3 |
t2 |
k2 |
|
|
1 |
|
k3 |
|
|||
m |
n |
|
|
||||
2 |
2 |
|
|
||||
|
|
|
t4 |
k4 |
t |
||
|
|
|
|
|
|||
t |
|
t4 |
|
t5 |
k5 |
|
N 4 |
|
|
|
|
||||
A |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
A |
|
20 |
40 60 |
80 B,% |
A |
||
t1 |
|
Ж |
|
|
t2 |
|
|
|
B |
|
|
|
|
|
t3 |
Ж+ C |
Ж+ |
|
|
N |
|
|||
|
|
D |
D |
|
|
Эвтектика + |
Эвтектика )( |
Эвтектика + |
|
|
|
|||
|
|
|
вт |
|
|
|
|
||
|
вт |
|
вт |
|
|
|
|
|
G |
Z |
|
B,% |
|
B |
Рис. 15
зация сплава: он будет состоять из кристаллов $твердого раствора с концентрацией, соответствующей среднестатистическому составу (50% А и 50% В).
При неравновесной кристаллизации этого же сплава при темпера$ туре t1 будут выделяться первые кристаллы $твердого раствора, кон$ центрация которых также будет соответствовать точке k1. Однако при температуре t2 концентрация новых кристаллов и концентрация ранее выделившихся при температуре t1 кристаллов будут различать$ ся. Это обусловлено тем, что при большой скорости охлаждения не$ возможно путем диффузии выровнять химический состав кристал$ лов. Усредненная концентрация будет превышать равновесную кон$ центрацию при заданной температуре и располагается справа от ли$ нии солидус. При неравновесной кристаллизации при температуре t4 не происходит полной кристаллизации, сохраняется жидкая фаза. Таким образом, в условиях неравновесной кристаллизации сплавы затвердевают при более низких температурах (линия неравновесного солидуса зависит от температуры).
Так как при кристаллизации твердых растворов образуются кри$ сталлы дендритного типа, то периферийные слои кристаллов и ме$ жосные пространства, кристаллизующиеся в последнюю очередь, будут заметно различаться по составу, наблюдаются дендритные лик$ вации. Дендритные ликвации могут быть уменьшены при нагреве сплава до температур, обеспечивающих интенсивную диффузию ком$ понентов сплава.
При неравновесной кристаллизации сплавов с ограниченной ра$ створимостью компонентов и эвтектическим превращением (рис. 15, б) в области образования твердых растворов также наблюдается по$ явление неравновесного солидуса, и развивается дендритная ликва$ ция. Происходит смещение эвтектики, образуется квазиэвтектика.
28

В отличие от неравновесной |
t A |
|
|
|
|
|
кристаллизации для неравновес$ |
|
|
I |
|
|
|
ной перекристаллизации требу$ |
|
|
|
|
|
|
ется значительно большее пере$ |
|
|
|
|
|
E M |
охлаждение. Рассмотрим про$ |
|
|
|
|
D |
|
цесс неравновесной перекристал$ |
|
1 |
|
|
|
|
лизации на примере распада твер$ |
|
|
1 |
|
|
|
дого раствора при изменении его |
|
|
|
|||
|
|
1 |
|
|
|
|
предельной растворимости с из$ |
|
|
|
|
|
|
|
|
|
|
|
|
|
менением температуры (рис. 16). |
|
|
II |
|
|
|
В условиях ускоренного ох$ |
|
|
|
|
||
|
|
K |
|
|
||
лаждения сплава с пересыщен$ |
F F |
F F |
F |
|
||
ным твердым раствором (напри$ |
|
|
|
|
B,% |
|
|
|
|
|
|
|
|
мер, сплав 1) выделение избыточ$ |
|
|
|
|
Рис. 16 |
|
ной фазы будет начинаться при |
|
|
|
|
|
|
температурах ниже температур, расположенных на равновесной ли$ нии предельной растворимости компонентов (линия DF). Чем боль$ шескоростьохлаждения,темприболеенизкихтемпературахбудетпро$ ходить выделение избыточной фазы (точки 1 или 1 вместо точки 1). Соответственно, кристаллов избыточной фазы будет больше и они будут мельче. При очень большом переохлаждении выделения избы$ точной фазы может вообще не быть (линии DF , DF ), т. е. произой$ дет подавление распада твердого раствора.
3.4.Связь между свойствами сплавов
итипом диаграмм состояния
Между типом диаграмм состояния и свойствами сплавов суще$ ствует определенная взаимосвязь и впервые эту связь установил
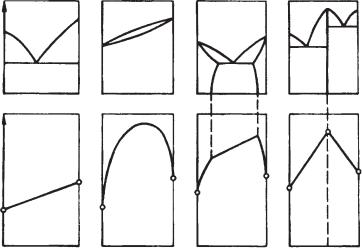
Н.С. Курнаков. В схематичном виде она показана на рис. 17.
Усплавов, кристаллизующихся с образованием эвтектики во всем диапазоне концентраций, свойства изменяются по линейному зако$ ну в интервале между свойствами чистых компонентов (рис. 17, а).
Усплавов, кристаллизующихся с образованием непрерывных твер$ дых растворов, свойства изменяются по кривой с максимум свойств, значительно отличающихся от свойств компонентов (рис. 17, б).
При образовании ограниченных твердых растворов свойства спла$ вов в области однофазных твердых растворов изменяются по нели$ нейному закону, а в двухфазной области – по линейному (рис. 17, в).
Если при кристаллизации сплавов образуется химическое соеди$ нение, то свойства сплавов при концентрации компонентов, соответ$ ствующей образованию этого химического соединения, достигают
29
a)
Температура
Свойства
|
б) |
в) |
г) AnBm |
|
|
B |
B |
B |
|
A |
A |
|||
|
|
|||
|
|
|
||
|
|
A |
B |
|
|
A |
|
||
|
|
|
|
|
|
AnBm |
|
B |
B |
B |
|
|
B |
|
|
|
|
|
|
|
A |
A |
A |
A |
|
|
|
|
|
|
B,% |
B,% |
B,% |
B,% |
|
|
Рис. 17 |
|
максимума (или минимума) на кривой изменения свойств с соответ$ ствующим изломом кривой. Точка перелома называется сингуляр$ ной точкой (рис. 17, г).
Эти закономерности указывают на то, что у твердых растворов такие свойства, как твердость, удельное электрическое сопротивле$ ние, коэрцитивная сила и другие, всегда превосходят свойства ис$ ходных компонентов. Эти закономерности являются основой при разработке составов сплавов с заданными свойствами. Однако эти закономерности относятся к сплавам в равновесном состоянии, по$ этому применение их ограничено.
Диаграммы состояния тройных сплавов представляют собой про$ странственные фигуры, основанием которых служит равносторон$ ний треугольник, в вершинах расположены компоненты. Для упро$ щения изображения используют вертикальные (политермические) и горизонтальные (изотермические) сечения. Вертикальные сечения по своему виду похожи на двойные диаграммы, но в принципе они таковыми не являются, и поэтому называются псевдобинарными диаграммами. Такие диаграммы вместе с изотермическими разреза$ ми используются при изучении многокомпонентных (более четырех компонентов) систем.
30
