
Тесты для стомат дневное отделен
.doc
Часть энергии системы, которую можно использовать для совершения работы при постоянной температуре и давлении, называется:
энтальпией
связанной энергией
свободной энергией
энтропией
Синтез АТФ в клетках эукариот протекает на:
внутренней мембране митохондрий
наружной мембране митохондрий
мембранах ЭПР
плазматической мембране
Если скорость реакции увеличилась в 27 раз при повышении температуры на 30оС, то температурный коэффициент скорости равен….
2,7
3
2
9
Для защиты медных изделий от коррозии в качестве анодного покрытия можно использовать …
Pt
Ag
Au
AI
Металлом, который можно получить электролизом водного раствора его соли, является…
AI
Na
K
Cu
Физическая адсорбция от химической отличается…
невысоким тепловым эффектом и необратимостью
невысоким тепловым эффектом и обратимостью
низким тепловым эффектом и необратимостью
низким тепловым эффектом и обратимостью
Методы получения коллоидных растворов, основанные на объединении более мелких частиц в более крупные, называются…
диспергационными
пептизационными
конденсационными
гидролитическими
Для золя Fe(OH)3, полученного гидролизом его хлорида, потенциалопределяющим (ПОИ) является ион…
H+
OCI-
Fe3+
CI-
Какой из следующих электродов применяется в качестве электрода сравнения в потенциометрическом методе анализа?
хлорсеребряный
стеклянный
платиновый
электрод с кальциевой функцией
Какая из приведенных реакций будет протекать на хлорсеребряном электроде, если в гальваническом элементе он является анодом?
AgCI + е- = Ag + СI-
Ag + СI- + е- = AgCI
Ag + СI- - е- = AgCI
AgCI - е- = Ag + СI-
Какой из следующих электродов применяется в качестве индикаторного при кислотно-основном титровании потенциометрическим методом ?
платиновый электрод
медный электрод
электрод с натриевой функцией
стеклянный электрод
Осмотическое давление крови человека в норме составляет 780 кПа. Какой из ниже перечисленных растворов NaCl создает такое же осмотическое давление?
5% р-р
0,1% р-р
10% р-р
+0,9% р-р
Формула π=CRT (закон Вант-Гоффа), показывающая зависимость осмотического давления от концентрации и температуры, применима….
+только к растворам неэлектролитов
к любым растворам
только к растворам электролитов
к растворам слабых электролитов
Плазмолиз клеток будет наблюдаться при помещении их в раствор NaCl концентрации…?
0,1% р-р
+10% р-р
0,9% р-р
0,5% р-р
Формула π=CRT (закон Вант-Гоффа) может быть применена к растворам электролитов после введения в качестве сомножителя…?
степени диссоциации α
константы диссоциации Кд
+изотонического коэффицента і
диэлектрической проницаемости ε
Какой раствор изотоничен по отношению к 0,9% раствору NaCl ?
+раствор любого соединения, имеющего такую же концентрацию частиц, как и 0,9% NaCI
раствор любого соединения, имеющий концентрацию 0,9%
раствор NaCI-любой концентрации
раствор NaCI с осмотическим давлением до 260-300 кПа
Определите преимущественное направление диффузии при помещении клетки в гипотонический раствор NaCl.
NaCI диффундирует из клетки
H2O диффундирует из клетки
NaCIдиффундирует в клетку
+H2O диффундирует в клетку
Какая соль наиболее растворима (в скобках дана величина Ks):
AgI (1.5·10-16)
AgBr (4.4·10-¹³)
AgSCN (1.2·10-¹²)
+AgCl (1.8·10-¹º)
Наименее растворима в воде соль (в скобках дана величина Ks)
BaSO3 (1·10-7)
CaSO4(1·10-5)
+CaCO3 (5·10-9)
BaC2O4 (1,1·10-7)
Концентрация катиона А в насыщенном растворе труднорастворимой соли типа АВ2 равна 1·10-³ моль/л. Вычислить Ks этой соли.
1·10-6
+1·10-9
1·10-9
1·10-3
Концентрация аниона В в насыщенном растворе соли типа АВ2 равна 2·10-4 моль/л. Вычислить Ks этой соли.
8·10-12
1,4·10-2
+4·10-12
4·10-8
Основное условие образование осадка.
Пс=Ks
Пс<Ks
+Пс>Ks
Пс«Ks
Основное условие растворение осадка.
Пс=Ks
+Пс<Ks
Пс>Ks
Пс«Ks
Основную соль (гидроксосоль) при гидролизе образует:
Na2CO3
AgNO3
+AICI3
K3PO4
Кислую соль при гидролизе образует:
Cr2(SO4)3
ZnCl2
Na2SO4
+K2S
Гидролизуется по катиону соль:
+MgCl2
Сa(NO3)2
CH3COOK
Na2CO3
Гидролизуется по катиону и аниону соль:
Na2CO3
(NH4)2SO4
+(NH4)2CO3
CH3COONa
Не подвергается гидролизу соль:
K3PO4
+СaCl2
Na2CO3
Na2S
Гидролизуется по аниону соль:
+K2SO3
K2SO4
ZnSO4
NaNO3.
В растворе, какой соли лакмус окрашен в розовый цвет, а фенолфталин – бесцветен:
СaCl2
K2SO3
NaNO3
+AlCl3
В растворе какой лакмус не изменяет окраску:
CH3COONa
+CH3COONH4
Na2CO3
NH4Cl
Восстановите левую часть ионного уравнения гидролиза….…+… ⇄ Al(OH)2+ + Н+ :
Al3+ +2НОН ⇄ Al(OH)2+ + Н+
+AlOH2+ + НОH ⇄ Al(OH)2+ + Н+
Al3+ + OH− +НОН ⇄ Al(OH)2+ + Н+
Al2+ +2НОН ⇄ Al(OH)2+ + Н+ :
Константа гидролиза реакций CO32− + НОН ⇄ HCO3− + OH−:
[CO32−]
[HCO3−][OH−]
[HCO3−] + [OH−]
[CO32−]
+[HCO3−] [OH−]
[CO32−]
[CO32−] [HOH]
[HCO3−][OH−]
Константа гидролиза реакции: NH4 + + CH3COO− + НОH ⇄ NH4ОH + CH3COOH:
[NH4ОH] [CH3COOH]
[NH4 +][CH3 COO−]
[NH4 +][CH3 COO− ]
[NH4ОH] [CH3COOH]
[NH4ОH]
[NH4 +][CH3COO−]
+[CH3COOH]
[NH4 +][CH3 COO−]
При сливании растворов CrCl3 и K2S идет:
первая ступень гидролиза с образованием CrOHS и KHS
обменная реакция с образованием Cr2S3 и KCl
+взаимное усиление гидролиза с образованием Cr(OH)3 и H2S
окислительно-восстановительная реакция
При сливании растворов Al2(SO4)3 и Na2CO3 идет:
обменная реакция с образованием Al2(CO3) 3 и Na2SO4
+взаимное усиление гидролиза с образование Al(OH)3, CO2 и Na2SO4
окислительно-восстановительная реакция;
первая ступень гидролиза солей с образованием AlOHSO4 и NaHCO3
Степень гидролиза Na3PO4 уменьшается при добавлении:
+HCl
CO2
NaCl
NaOH
Степень гидролиза ацетата натрия возрастает при:
уменьшение температуры
+увеличение температуры
добавление NaOH
увеличение концентрации раствора
Степень гидролиза AlCl3 возрастает при:
+добавление Na2CO3
уменьшение температуры
добавление HCl
увеличение концентрации раствора
Наиболее сильный восстановитель:
+S2O32− Еº (S4O62−/S2O32−)= 0,096 В
Fe2+ Еº(Fe3+ /Fe2+)= 0,77 В
S2− Еº (S2−/ H2S)= 0,14 В
Sn2+ Еº(Sn4+/Sn2+)= 0,156 В
Наиболее слабый окислитель:
H2O2 Еº (H2O2/H2O)=1,77 В
BiO3− Еº (BiO3−/ Bi3+)=1,8 В
+PbO2 Еº (PbO2/ Pb2+)= 1,48 В
S2O82− Еº (S2O82−/2SO42−)= 2,0 В
Наиболее сильный окислитель:
ClO4− Еº (ClO4−/Cl−)= 1,38 В
ClO3− Еº (ClO3−/Cl−)= 1,45 В
Cl2 Еº (Cl2/2Cl−)= 1,36 В
+HClO Еº (HClO/Cl−)= 1,5 В
Наиболее слабый восстановитель:
+Fe2+ Еº(Fe2+/Fe3+)= 0,77 В
S2O32− Еº (S4O62−/S2O32−)= 0,96 В
S2− Еº (S2−/H2S)= 0,14 В
Sn2+ Еº(Sn4+/Sn2+)= 0,15 В
Степень окисления центрального атома (иридий) в соединении K3[Ir(C2O4)2Cl2] равна:
-3
+6
++3
-6
Гексацианоферрат (II) бария – это:
Ba[Fe(CN)6]
+Ba2[Fe(CN)6]
Ba[Fe(CN)6]2
Ba2[Fe(CN)6]3
Степень окисления центрального атома равна +3 в соединении:
+[Cr(H2O)4Cl2]Cl
[Pt(NH3)2Br2]
[Cu(NH3)4]SO4
K2[PtCl4]
Тетрахлородигидроксоплатинат (IV) аммония – это:
(NH4) [Pt (H2O)2Cl4]
(NH4) [Pt (HO)2Cl4]
+(NH4)2 [Pt (HO)2Cl4]
(NH4)3 [Pt (H2O)2Cl4]
Степень окисления центрального атома в комплексном ионе [Ni(H2O)4(CO3)2]2- равна:
-4
++2
-2
+4
Тетрацианодиамминхромат (III) бария – это:
+Ba [Cr(NH3)2(CN)4]2
Cr[Ba(NH3)2(CN)4]2
Ba[Cr(NH3)2(CN)4]
Cr[Ba(NH3)2(CN)4]
Константа нестойкости комплексного иона [Cu(NH3)4]2+ - это:
[Cu2+]·4[NH3]
[Cu(NH3)4]2+
[Cu2+]·4[NH3]
[Cu2+]·[NH3]
[Cu(NH3)4]2+
+[Cu2+]·[NH3]4
[Cu(NH3)4]2+
Наиболее устойчив комплексный ион:
[HgCl4]2-, КН=8,5·10-15
[HgI4]2-, KH=1,5·10-30
+[Hg(CN)4]2-, KH=4·10-42
[HgBr4]2-, KH=1·10-21
Константа нестойкости комплексного иона [Ag(NH3)2]+ - это:
[Ag+][NH3]2
[Ag+]·2NH3]
[Ag+][NH3]
[Ag(NH3)2]+
+[Ag+][NH3]2
[Ag(NH3)2]+
Наиболее устойчив комплексный ион:
[Ag(CN)2]-, KH=1,1 ·10-21
+[Hg(CN)4]2-, KH=4·10-42
[Cu(CN)4]2-, KH=5·10-31
[Cd(CN)4]2-, KH=7,8 ·10-18
В растворе содержится 0,1 моль соединения PtCl2·3NH3. Реагируя с AgNO3. оно образует 0,1 моль осадка AgCl. Придайте исходному веществу координационную формулу.
[PtCl2(NH3)3]
[Pt(NH3)3]Cl2
[PtCl2](NH3)3
+[PtCI(NH3)3]Cl
В растворе содержится 0,1 моль соединений PtCl4 ·4NH3. Реагируя с AgNO3, оно образует 0,2 моль осадка AgCl. Придайте исходному веществу координационную формулу.
[PtCl3(NH3)4]Cl
[PtCl(NH3)4]Cl3
+[PtCl2(NH3)4]Cl2
Pt(NH3)4]Cl4
В растворе содержится 0,01 моль соединения CrCl3· 4NH3. Реагируя с AgNO3 оно образует 0,01 моль осадка AgCl. Придайте исходному веществу координационную формулу.
[CrCl3] (NH3)4
[Cr(NH3)4]Cl3
+[CrCl2(NH3)4]Cl
[CrCl(NH3)4]Cl2
Какое из приведенных соединений является слабым электролитом?
CH3COONa
HCl
+Al(OH)3
Ca(OH)2
Какое из приведенных соединений является сильным электролитом?
NH4OH
CH3COOH
Mg(OH)2
+CH3COONa
Какая из ниже перечисленных формул является выражением закона разбавления Оствальда?
+![]()
![]()
![]()
![]()
Какая из ниже приведенных формул является выражением водородного показателя?
рН = [H+][OH-]
рН = -lg[H+]
+рН
=![]()
[H+]
=![]()
Для каких из приведенных соединений степень диссоциации будет равна 1: 1.HCl, 2.NaCl, 3.CH3COOH, 4.CH3COONa ?
только 1,2 и 3
только 2,3 и 4
+только 1,2 и 4
только 1,3 и 4
Какая из ниже приведенных формул является выражением ионного произведения воды?
+[H+][OH-]=10-14
[H+]+[OH-]=10-14
[H+]
=
![]()
[H+]=КкСк
Какая из приведенных формул является расчётной для концентрации ионов водорода слабых кислот?
[H+]![]()
[H+]![]()
+[H+]
=
![]()
[H+]=КкСк
Для
каких из приведенных соединений степень
диссоциации можно рассчитать по формуле
![]() ?
?
NaCl
+CH3COOH
HCl
NaOH
Чему равна величина рН раствора уксусной кислоты с концентрацией 0,1 моль/л?
+2,87
1
5,74
8,26
Для
каких из приведенных соединений степень
диссоциации можно рассчитать по формуле
[H+]
=
![]() :
1. HCOOH,
2. CH3COOH,
3.NH4OH,
4.HNO2
?
:
1. HCOOH,
2. CH3COOH,
3.NH4OH,
4.HNO2
?
+только 1,3 и 4
только 1,2 и 4
только 2,3 и 4
только 1,2 и 3
По какому из приведенных уравнений можно рассчитать величину [H+] кислотного буферного раствора?
+![]()
![]()
H+] = КкСкСс
[H+]
=
![]()
По какому из приведенных уравнений можно рассчитать величину рН основного буферного раствора?
![]()
![]()
+![]()
![]()
В каких случаях величину рН кислотного буферного раствора можно рассчитать по формуле рН=рКк?
если концентрация кислоты намного меньше концентрации соли
+если концентрация кислоты равна концентрации соли
если концентрация кислоты равна нулю
если концентрация соли равна 1 моль/л
Чему равна величина рН аммиачного буферного раствора, если рК(NH4OH)=4,75, C(NH4OH)=0,1 моль/л и С(NH4Cl)=0,2 моль/л?
5,05
+8,95
9,55
4,45
Чему равна величина рКк слабой кислоты, если рН=4,94, Ск = 0,2 моль/л и Сс = 0,3 моль/л?
5,12
4,94
8,88
+4,76
В каком соотношении по молям нужно взять ацетат натрия и уксусную кислоту, чтобы приготовить буферный раствор с рН=4,16. если рК(CH3COOH)=4,76?
+n(CH3COONa) : n(CH3COOH) =1: 4
n(CH3COONa) : n(CH3COOH) =4: 1
n(CH3COONa) : n(CH3COOH) =1: 2
n(CH3COONa) : n(CH3COOH) =2: 1
Чему равна величина рН буферного раствора, полученного смешением 6 мл раствора уксусной кислоты с концентрацией 0,2 моль/л и 4 мл раствора ацетата натрия с концентрацией 0,2 моль/л, если рК (CH3COOH)=4,76?
4,94
4,76
+4,58
9,42
По
какой формуле можно рассчитать буферную
ёмкость буферного раствора по кислоте?![]()
![]() |Vб.р
|Vб.р
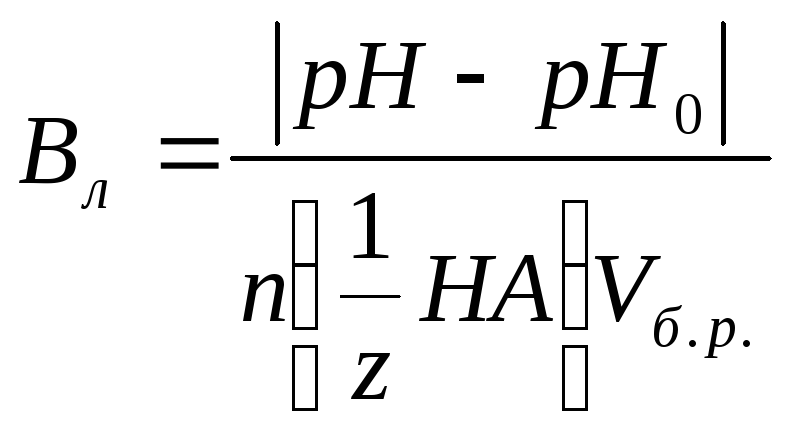
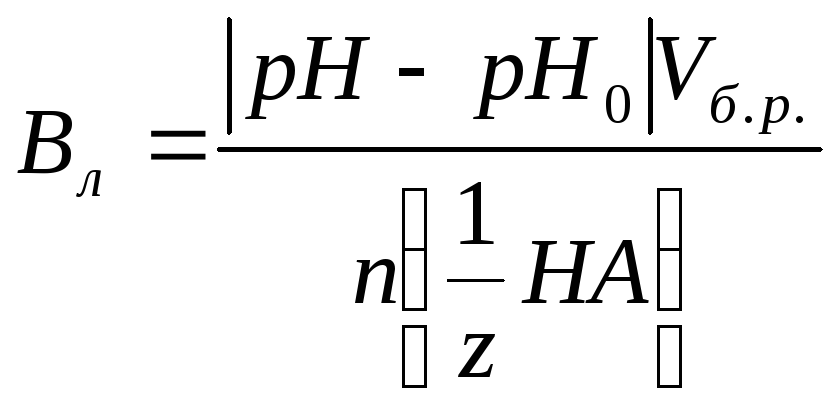
+
Чему равна буферная ёмкость раствора, если для уменьшения величины его рН на 2,0 к 4 л этого раствора нужно добавить 0,4 моль одноосновной кислоты?
+0,05
3,2
0,8
1,25
Какое количества вещества одноосновной кислоты нужно добавить к 4 л буферного раствора, буферная ёмкость которого равна 0,1 моль/л, чтобы уменьшить величину его рН на 0,5?
0,05
0,1
+0,2
0,4
Группа атомов, определяющая характерные свойства определенного класса органических соединений, называется……
структурным звеном
гомологической
функциональной
радикалом
Амил (пентил) имеет формулу:
- С4Н9
- СН3
+- С5Н11
- С7Н15
Данное соединение СН3 - СН - СН - СН2 - СН3 имеет название


CH3 СН3
по международной номенклатуре:
2-метил-3-этил-метан
изопропил-метил-этил-метан
2,2-диметил-пентан
+2,3-диметил-пентан
Характерными для алканов являются реакции:
присоединения
отщепления
+замещения
полимеризации
Алканы при обычных условиях:
+не окисляются
окисляются до спиртов
окисляются до альдегидов
окисляются до кислот
Найдите 3- метилгексен-2:
Н 3С
- СН2
- С = СН - СН2
- СН3
3С
- СН2
- С = СН - СН2
- СН3
СН3
Н3С - СН = СН - С = СН - СН3

CH3
+Н3С - СН2 - СН2 -С = СН - СН3

CН3
Н3С – СН2 - СН - СН2 - СН2 - СН3

CH3
Качественная реакция на непредельные углеводороды:
с [Ag( NH3)2]OH
с Cu(OH)2
+с бромной водой
с FeCl3
Между атомами углерода в молекуле ацетилена имеются следующие связи:
две -связи и одна π - связь
три -связи
три π -связи
+одна -связь и две π -связи
Бутадиен имеет формулу:
СН3 -СН2 - СН2 - СН3
+СН2 = СН - СН = СН2
СН2 = СН - СН2 - СН3
С Н
- С СН2
- СН3
Н
- С СН2
- СН3
Систематическое название ароматического углеводорода:
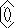

Н3С - СН - СН3
пропилбензол
диметилфенилметан
фенилдиметилметан
+изопропилбензол
Радикал фенил имеет формулу:
С6Н13 -
С6Н5 - СН2 -
+С6Н5 -
С6Н4(СН3) -
Реакции замещения в бензольном ядре идут по механизму:
радикального замещения
нуклеофильного замещения
+электрофильного замещения
электрофильного присоединения
Хлороформ имеет формулу:
CHJ3
С2Н5Сl
СН3Сl
+СНСl3
Йодоформ имеет формулу:
СНСl3
+CHJ3
CH3J
С2Н5J
Общая формула спиртов:
R - O - R′
R - C
- OH
- C
- OH
О
R - C - O - R′

О
+R - OH
При окислении первичных спиртов образуются:
кетоны
перекисные соединения
+альдегиды
гидроперекиси
При окислении вторичных спиртов образуются:
+кетоны
карбоновые кислоты
альдегиды
гидроперекиси
К двухатомным фенолам относится:
пирогаллол
флороглюцин
фенол
+резорцин
Общим реактивом на фенолы является:
р-р сульфата меди
р-р нитрита натрия
р-р нитрата серебра
+р-р хлорида железа III
Альдегидную группу идентифицируют реакцией образования:
йодоформа
+серебрянного зеркала
азокрасителя
сложного эфира
Альдегиды с жидкостью Фелинга при нагревании образуют осадок:
желтого цвета
+кирпично-красного
черного
белого
К двухосновным кислотам относится:
муравьиная кислота
бензойная кислота
салициловая
+щавелевая
Аминогруппа ( -NH2) является ориентантом 1 рода и направляет электрофильные реагенты в положение:
орто-
мета-
пара-
+орто- и пара-
Качественной реакцией на винную кислоту является реакция взаимодействия с:
CuSO4
+КОН (недостаток)
FeCl3
СaCl2
При гидролизе сложного эфира R - C – OŔ образуются:

O
две молекулы спирта
две молекулы кислоты
алкоголят и кислота
+одна молекула спирта и одна молекула кислоты
Аминокислоты имеют общую формулу:
R - C - NH2

O
+ R
– СН-COOH
R
– СН-COOH
NH2
R R


NH2 - CН - С - N - СН - COOH


O Н
R-NH-R
Нейтральной аминокислотой является:
аргинин
лизин
валин
аспарагиновая кислота
Качественные реакции на белки все, кроме:
ксантопротеиновой
биуретовой
осаждения солями тяжелых металлов
+образования акролеина
Биологическая ценность пищевого белка зависит от:
порядка чередования аминокислот
присутствия незаменимых аминокислот
присутствия частично заменимых аминокислот
присутствия только условно заменимых аминокислот (тирозина и цистеина)
При внутримолекулярном дезаминировании аминокислот образуются:
предельные кислоты
непредельные кислоты
гидроксикислоты
кетокислоты
Биогенные амины образуются из аминокислот в результате реакции:
ώ -декарбоксилирования
α- декарбоксилирования
декарбоксилирования, сочетанного с реакцией конденсации
γ- декарбоксилирования
В лечении заболеваний ЦНС используется (γ-аминомасляная кислота) декарбоксилированное производное:
тирозина
фенилаланина
глутаминовой кислоты
аспарагиновой кислоты
Источником аммиака в организме не является
