
1. Изохорный процесс изменение состояния идеального газа.



Для получения значения энергии запишем 1ое начало термодинамики.

T-S диаграмма используется для определения количества подведенного или отведенного тепла.
Т.к Т2>Т1 в процессе 1-2, то тепло подводится,
если Т2<Т1 то тепло
отводится. Кол-во подведенного и
отведенного тепла определяется как
площадь под кривой 1-2. Удельная
располагаемая работа обозначается
 .
.
Изменение удельной энтропии найдем из 1го и 2ого Н Т/Д.
 Количество
полной теплоты идет на изменение
энергии.
Количество
полной теплоты идет на изменение
энергии.
2. Изобарный процесс изм сост ид газа. р=соnst, dp=0



Часть теплоты подведенной к рабочему телу идет на изменение внутренней энергии, а часть на совершение работы.
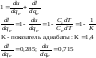
При изобарном процессе 28,5% всей подведенной теплоты расходуется на совершение работы, 71,5%-идет на изменение внутренней энергии тела.

Теплота подведенная к рабочему телу идет на увелич энтальпии, а кол-во подведенной теплоты определяется как площадь под кривой на TS – диаграмме.
Изменение энтропии.
Т.к. Ср>Сv , то изменение энтропии при изобарном процессе будет больше чем при изохорном. Изобара 1-2 при одинаковой температуре Т1 и Т2 более пологая чем изохора 1,2’.

3. Изотермический пр-с изм сост ид газа. Т=const. dT=0


 В
изотермическом пр-се идеальная работа
газа, располагаемая работа, изменение
объема и удельное количество теплоты
равны между собой.
В
изотермическом пр-се идеальная работа
газа, располагаемая работа, изменение
объема и удельное количество теплоты
равны между собой.
Изменение энтропии:

4. Адиабатный пр-с изм сост ид газа.
Адиабатным процессом наз пр-с происходящий без теплообмена с окруж средой.


Первое
Т/Д:

Адиабата идет круче чем изотерма.

В адиаб пр-се работа совершается за счет убыли внутр энергии рабочего тела.

Располагаемая
работа l0
для адиаб пр-са в К раз больше удельной
работы расширения газа и противоположна
ей по знаку.

Из ур-я адиабаты видно, т.к. K>1, то адиабата идет круче чем изотерма. Т.к. адиабата идет круче чем изотерма то адиаб пр-с идет без теплообмена с окр средой и расширение газа происходит только за счет падения ее внутр энергии, в изотерм пр-се расширение газа происходит за счет подведения теплоты. Если от т А сжать газ, то адиабата А1 располагается круче изотермы А1’, т.к. при адиабатном пр-се теплота не отводится и температура газа с увеличением давления растет больше чем в изотермическом пр-се.
5. Политропный пр-с – прс-с в котором удельная теплоемкость остается постоянной. График процесса политропы – это кривая которая описывает газовые пр-сы, в кот-ых происходит изменение всех термодинамических параметров.
Кол-во подведенной
теплоты:
 Еслиn=
Еслиn= тоv=сonst;
n=0
– p=const;
n=1
– T=const;
n=k
– уравнение адиаб пр-са S=const.
Политропный пр-с обобщает все раннее
рассмотренные пр-сы.
тоv=сonst;
n=0
– p=const;
n=1
– T=const;
n=k
– уравнение адиаб пр-са S=const.
Политропный пр-с обобщает все раннее
рассмотренные пр-сы.
Соотношение
параметров. Заменим
показатель адиабаты на показатель
политропы. Получим,
 Работа
в политропном пр-се. Для работы в
политропном пр-се используется выражение
работы в адиаб пр-се заменимK
на n.
Работа
в политропном пр-се. Для работы в
политропном пр-се используется выражение
работы в адиаб пр-се заменимK
на n.
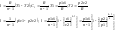 Располагаемая
работаl0
в n
раз больше удельной работы:
Располагаемая
работаl0
в n
раз больше удельной работы:

Теплоемкость:


Пр-сы начинающиеся в т А и проходящие с расширением рабочего тела имеют положительную работу. Пр-сы в области 5,6,7,8 имеют отрицат работу, т к рабочее тело в этих областях сжимается. Для 1,2,3,8 проходят при подводе теплоты, а в области 4,5,6,7 – с отводом теплоты. Пр-сы происходящие во 2ой, 7,8 сопровожд повышением температуры раб тела. 3,5,6,4 – температура понижается. 3 – при подводе теплоты происходит падение температуры раб тела, 7 – происходит повыш темпер, при отводе теплоты к раб телу.
Вывод изменения энтропии:

