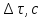на флешку студентам / МЕТОДИЧКИ / Методички (мол) / Формат / 217
.docxКафедра общей физики ПГУ
Лаборатория молекулярной физики
Лабораторная работа № 217

Лабораторная работа № 217
ОПРЕДЕЛЕНИЕ УДЕЛЬНОЙ ТЕПЛОЕМКОСТИ ТВЕРДЫХ ТЕЛ
Принадлежности: установка ФПТ1-8.
Цель работы:
1. Измерение теплоемкости твердых тел при высоких температурах.
2. Проверка выполнимости закона Дюлонга и Пти для исследуемых образцов.
Введение. Теплоемкостью С тела называется отношение элементарного количества теплоты δQ, сообщенного телу в каком-либо процессе, к соответствующему изменению температуры тела
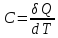
Теплоемкость зависит от массы тела, его химического состава, термодинамического состояния и вида процесса сообщения теплоты.
Удельной теплоемкостью Суд называется теплоемкость единицы массы однородного вещества. Для однородного тела
 ,
,
где m – масса вещества.
Молярной
теплоемкостью
 называется
теплоемкость одного киломоля (моля)
вещества
называется
теплоемкость одного киломоля (моля)
вещества
 ,
,
где µ- молекулярный вес вещества.
Согласно классической теории теплоемкости при не слишком низких температурах, молярная теплоёмкость химически простых веществ в кристаллическом состоянии одинакова и равна 25 Дж/(моль∙к). Это утверждение составляет содержание закона Дюлонга и Пти, установленного опытным путем.
Между частицами, образующими кристаллическую решетку твердых тел, существуют силы взаимодействия. Расположение частиц в узлах кристаллической решетки отвечает минимуму их взаимной потенциальной энергии. При смещении частиц из положения равновесия в любом направлении появляется сила, стремящаяся вернуть частицу в первоначальное положение, вследствие чего возникают ее колебания.
При
точном рассмотрении задачи необходимо
учитывать, что частицы в решетке
взаимодействуют друг с другом и их,
колебания надо рассматривать как
связанные. Однако при достаточно высоких
температурах, когда энергия становится
большой, колебания частиц можно
рассматривать приближенно как н друг от друга.
друг от друга.
Полная энергия частицы U равна сумме кинетической Ек и потенциальной Еп:
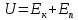
Колебания
частиц в решетке приближенно являются
гармоническими. При этом как кинетическая,
так и потенциальная энергии гармонических
колебаний частицы являются периодическими
функциями времени и их средние значения
 и
и
 равны друг другу:
равны друг другу:
 =
=
 Поэтому
среднее значение полной энергии
Поэтому
среднее значение полной энергии
 (1)
(1)
С другой стороны, из кинетической теории идеального газа известно, что средняя кинетическая энергия одноатомных молекул (изолированных частиц)
 (2)
(2)
где k – постоянная Больцмана, Т - абсолютная температура.
Поскольку, как было отмечено, атомы или ионы кристаллической решетки при достаточно высоких температурах колеблются независимо друг от друга, к ним также применима формула (2). Тогда из (1) и (2) имеем,
 .
(3)
.
(3)
Полную внутреннюю энергию одного моля твердого тела получим, умножив среднюю энергию одной частицы на число независимо колеблющихся частиц, содержащихся в одном моле, т. Е. на постоянную Авогадро NА:
 (4)
(4)
где R - молярная газовая постоянная.
Для
твердых тел, вследствие малого коэффициента
теплового расширения при постоянном
давлении и постоянном объеме практически
не различаются. Поэтому общее выражение
теплоемкости твердого тела совпадает
со значением молярной теплоемкости при
 :
:
 .
Из формулы (4) окончательно следует, что
.
Из формулы (4) окончательно следует, что
 .
(5)
.
(5)
 Подставляя
численное значение молярной газовой
постоянной, получаем
Подставляя
численное значение молярной газовой
постоянной, получаем
 =25Дж/(моль∙К)
=25Дж/(моль∙К)
Это равенство выполняется, с довольно хорошим приближением для многих веществ при комнатной температуре, для более низких температур наблюдается отклонение от него рис.1. Вблизи абсолютного нуля молярная теплоемкость всех тел пропорциональна ТЗ, и только при достаточно высокой, характерной для каждого вещества температуре начинает выполняться равенство (5).
Строгая теория теплоемкости твердых тел создана Эйнштейном и Дебаем. Она учитывает, что колебания частиц в кристаллической решетке не являются независимыми и что энергия колебательного движения квантована.
Описание установки. Установка ФПТ1-8 рис . 2 представляет собой конструкцию настольного типа, состоящую из трех основных частей:
1) блока приборного БП-8,
2) блока рабочего элемента РЭ-8,
3) стойки.
На лицевой панели блока приборного БП-8 (1) находятся цифровой контроллер для измерения времени, вольтметр, амперметр, органы управления и регулирования установки. Визуально блок разделен натри функциональных узла: узел «ИЗМЕРЕНИЕ».узел «НАГРЕВ», узел «СЕТЬ».
Узел «ИЗМЕРЕНИЕ» состоит из цифрового контроллера для измерения времени, амперметра, вольтметра, и осуществляет замер величины тока, напряжения, времени проведения опыта.
Узел «НАГРЕВ» осуществляет включение и регулирование нагрева нагревателя.
Узел «СЕТЬ» осуществляет подключение установки к сети питающего напряжения.
Блок РЭ-8 (2) представляет собой коробчатый конструктив, укрепленный на горизонтальном основании стойки (3) . Несущими узлами блока РЭ-8 являются панель и кронштейн, скрепленные между собой винтами. Спереди блок РЭ -8 закрыт съемным экраном из орг стекла. При выполнении работы экран навешивается на заднюю стенку блока РЭ-8.
На панели расположен цифровой контроллер (6) для измерения температуры, внизу на выступающей панели размещены образцы (5) из различных материалов и рукоятка для установки образцов в нагреватель.
Нагреватель (4) состоит из металлического кожуха, теплоизолирующего материала, калориметра, с намотанной на нем спиралью, ручки для выталкивания образца из калориметра. В калориметр вмонтирован датчик контроллера для измерения температуры.
Принцип действия установки.
Удельная теплоемкость определяется по формуле

где Q- количество теплоты, поглощенное образцом при нагревании на ∆Т, m- масса образца, ∆Т – разность конечной и начальной температур.
Если для нагревания пустого калориметра на ∆Т требуется Q1 джоулей тепла , а для нагрева калориметра с исследуемым образцом на ∆Т требуется Q2 джоулей тепла, то на нагрев самого образца идет

В установке ФТПТ1-8 нагрев производится пропусканием тока через нагреватель.
Количество теплоты, выделяемое нагревателем

где I- ток через нагреватель, U- напряжение на нагревателе, τ- время нагрева.
Если мощность нагрева остается постоянной в течении всего эксперимента, то

где τ1- время нагрева пустого калориметра на ∆Т, τ2- время нагрева калориметра с образцом на ∆Т.
Тогда удельная теплоемкость определяется по формуле
 , (6)
, (6)
где I- сила тока, U- напряжение, m-масса исследуемого образца,∆τ=τ2-τ1.
Методика проведения эксперимента заключается в следующем. Сначала определяется зависимость приращения температуры от временя для пустого калориметра 1, затем для калориметра с исследуемым телом 2. При этом ток Iн в обмотку нагревательной спирали калориметра неизменен. В отсутствие теплообмена с окружающей средой эти зависимости были бы линейными. В реальных условиях графики этих зависимостей имеют вид, изображенный на рис. 3.
Для нагревателя пустого калориметра на ∆t градусов потребуется отрезок времени τ1, а для нагревания калориметра с телом потребуется больший промежуток времени τ2. Удельная теплоемкость исследуемого образца определяют по формуле (6).

Рис. 3
Измерения.
Внимание! Эксперимент проходит достаточно быстро, необходимо внимательно изучить порядок работы, заранее подготовить таблицу и научиться пользоваться секундомером.
-
Включить тумблер «вкл.» в модуле питания «сеть», расположенный на лицевой панели приборного блока (1) БП-8 рис.1.
-
Снять съемный экран из оргстекла с блока РЭ-8(2). При выполнении работы экран навешивается на заднюю стенку РЭ-8.Убедиться, что в калориметре (4) отсутствует образец. Плотно закрыть крышку калориметра. Записать над таблицей начальную температуру.
-
Подготовить к работе секундомер. Включить тумблер «вкл» в модуле «нагрев» приборного блока (1). При этом загорается сигнальная лампа. Регулятором модуля установить заданную мощность нагрева (сила тока I = 0.5А, напряжение U устанавливается автоматически). Записать в таблицу значения I и U. Во время измерений следить, чтобы показания вольтметра и амперметра не изменялись.
-
В таблицу №1 записывать показания температуры на цифровом контроллере(6) через каждые 30 секунд (не менее 10-12 измерений). Не нагревать пустой калориметр выше 700. После окончания измерений выключить нагреватель, открыть крышку калориметра. В течение 30 минут охладить калориметр. Для быстрого охлаждения использовать вентилятор. Вентилятор включается через блок питания. Пока охлаждается калориметр построить график зависимости разности температур ∆Т от времени нагревания τ (см. обработку результатов).
-
Определить массу одного из испытуемых образцов (5).Записать материал из которого изготовлен образец. Поместить образец в калориметр. Плотно закрыть крышку калориметра. Повторить п.3 и 4 Внимание! Максимальная температура нагрева 70 0 С. Данные записать в таблицу №2
-
После окончания измерений выключить нагреватель, открыть крышку калориметра и с помощью специального приспособления извлечь образец из калориметра. Будьте осторожны! Образец горячий!
Обработка результатов измерений.
-
Вычислить разность температур
 ,
где
,
где
 - температура пустого калориметра через
каждые 30 c
после начала нагрева,
- температура пустого калориметра через
каждые 30 c
после начала нагрева, -
температура пустого калориметра до
начала нагрева. Результаты записать в
таблицу№1.
-
температура пустого калориметра до
начала нагрева. Результаты записать в
таблицу№1. -
Построить графики зависимости
 от
времени τ для пустого калориметра.
от
времени τ для пустого калориметра. -
Вычислить разность температур
 ,
где
,
где
 - температура калориметра с исследуемым
образцом через каждые 30 c
после начала нагрева,
- температура калориметра с исследуемым
образцом через каждые 30 c
после начала нагрева, -
температура калориметра с исследуемым
образцом до начала нагрева. Результаты
записать в таблицу№2.
-
температура калориметра с исследуемым
образцом до начала нагрева. Результаты
записать в таблицу№2. -
На том же графике построить график зависимости
 от
времени τ для калориметра с исследуемым
образцом.
от
времени τ для калориметра с исследуемым
образцом. -
Найти по графику для трех значений разности температур
 разность
времени ∆τ нагревания калориметра с
исследуемым образцом и пустого
калориметра (см. рис 3).Данные записать
в таблицу №3.
разность
времени ∆τ нагревания калориметра с
исследуемым образцом и пустого
калориметра (см. рис 3).Данные записать
в таблицу №3. -
Рассчитать по формуле (6) удельную теплоемкость для значений разности времени нагревания, определенных в п. 5. Определить среднее значение удельной теплоемкости.
-
Рассчитать молярную теплоемкость по формуле:
 ,
где µ – молярная масса материала (для
одноатомных веществ атомная и молярная
массы совпадают),
,
где µ – молярная масса материала (для
одноатомных веществ атомная и молярная
массы совпадают),
 -
удельная теплоемкость тела.
-
удельная теплоемкость тела. -
Результаты измерений сравнить с табличными значениями и с предсказаниями закона Дюлонга и Пти.
-
Проанализировать построенные графики. Написать заключение о проведенной работе.
Таблица№1
Т0= I = U=
|
№ |
материал |
|
|
|
|
1 |
пустой |
30 |
|
|
|
2 |
|
30 |
|
|
Таблица№2
m=
|
№ |
материал |
|
|
|
|
1 |
|
30 |
|
|
|
2 |
|
30 |
|
|
Таблица№3
|
№ |
материал |
|
|
|
|
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
Ср. |
|
|
|
|
|
Табличные данные.
|
Материал |
Молярная масса, µ |
Удельная теплоемкость C, |
|
Медь |
63.5∙10-3 |
7.29 ∙102 |
|
Алюминий |
27
∙10-3
|
8.9 ∙ 102 |
|
Сталь |
56 ∙ 10-3 |
4.6 ∙102 |
Контрольные вопросы.
1. Что называется удельной, молярной теплоемкостью вещества?
2. Чем отличается теплоемкость газов и твердых тел?
3. Как получить закон Дюлонга и Пти исходя из классической теории теплоемкости?
4. Сравните (при помощи табличных значений) молярную теплоемкость жидких, твердых и газообразных тел. Сделайте выводы. Сравните удельные теплоемкости этих тел. Сделайте выводы. Как зависит теплоемкость от агрегатного состояния вещества?
5. Объясните принцип действия установки и методику выполнения лабораторной работы.
6. В чем проявляется недостаточность классической теории теплоемкостей?
Теплоемкость
газообразного водорода при Т=290 К,
Сv=4,90 .
Запишите значение теплоемкости в системе
СИ.
.
Запишите значение теплоемкости в системе
СИ.




 τ,с
τ,с