
02 Молекулярная физика / 02 Молекулярная физика
.pdfМОЛЕКУЛЯРНАЯ ФИЗИКА. ТЕРМОДИНАМИКА
Методические указания к выполнению контрольной работы № 2 по физике
Архангельск
2015
1

РЕКОМЕНДАЦИИ ПО РЕШЕНИЮ ЗАДАЧ
Хорошее усвоение теоретического материала невозможно без решения задач, помогающих лучше уяснить физический смысл явлений, законов, понятий. При решении задач целесообразно руководствоваться следующими правилами.
1.Внимательно прочитать условие задачи, уяснить, какой физический процесс или явление в ней рассматриваются.
2.Записать условие задачи в сокращенном виде, применяя общепринятые обозначения физических величин. При решении задач следует пользоваться Международной системой единиц (СИ). Все числовые величины должны быть приведены к этой системе. Следует проанализировать, все ли данные, необходимые для решения задачи, приведены в еѐ условии. Недостающие данные надо взять из справочных таблиц. Необходимо записывать также
ите величины, числовые значения которых не задаются, но о них можно судить по условию задачи. Например, если тело начинает двигаться из состояния
покоя, то следует записать, что начальная скорость х0 0 , если в задаче сказано, что какой-то величиной x можно пренебречь, обязательно следует записать, что x 0 и т. д.
3.Задачу следует обязательно пояснять чертежом или рисунком (если это возможно), выполняя их аккуратно с помощью чертежных принадлежностей. Обозначения на чертеже и в пояснениях решений должны быть одинаковыми. Не следует обозначать одну и ту же величину разными буквами, а также обозначать различные величины одними и теми же символами.
4.Решение задачи должно сопровождаться пояснениями. В пояснениях необходимо указывать те основные законы и формулы, на которых базируется решение задачи.
5.Как правило, задача по физике решается сначала в общем виде, то есть выводится формула, в которой искомая величина выражена через величины, заданные в условии задачи. При таком решении не происходит накопления погрешностей, неизбежных при промежуточных расчетах. В тех случаях, когда преобразования, необходимые для нахождения искомой величины в общем виде, слишком громоздки (например, при расчете токов, текущих в разветвленных цепях), допускается вычисление промежуточных величин.
6.Получив решение в общем виде, сделать анализ его размерности. Для этого подставить в правую часть полученной рабочей формулы вместо символов величин обозначения единиц измерений, провести с ними необходимые действия и убедиться в том, что полученная при этом единица соответствует искомой величине.
7.Произвести вычисления путем подстановки заданных числовых величин в расчетную формулу. Все вычисления рекомендуется выполнять с помо-
2

щью микрокалькулятора. При вычислениях соблюдать правила приближенных вычислений и округлений.
8.Оценить правдоподобность ответа. Такая оценка в ряде случаев позволяет обнаружить ошибочность ответа. Например, скорость тела не может быть больше скорости света в вакууме, коэффициент полезного действия теплового двигателя не может быть больше единицы и т.п.
9.Ответ должен быть записан с определенной степенью точности, соответствующей точности исходных данных.
1.МОЛЕКУЛЯРНАЯ ФИЗИКА. ГАЗОВЫЕ ЗАКОНЫ
Основные понятия, законы и формулы
1.1. Количество вещества – число структурных элементов (молекул, атомов, ионов и т.п.), содержащихся в теле или системе. Количество вещества выражается в молях. Моль равен количеству вещества системы, содержащей
столько же структурных элементов, сколько содержится атомов в нуклиде 12 С массой 0,0012 кг.
Количество вещества однородного газа:
|
|
|
|
|
|
|
N |
или |
m |
, |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
N A |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
где |
Н – число молекул газа в данном объеме; |
N A – постоянная Авогадро |
||||||||||||||||||||||
(число молекул в одном моле), N A |
6,02 1023 моль 1; m – масса газа; – мо- |
|||||||||||||||||||||||
лярная масса. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Если система представляет смесь нескольких газов, то количество веще- |
|||||||||||||||||||||||
ства системы: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
1 |
2 |
|
|
|
|
|
n |
|
N1 |
|
|
|
N2 |
|
|
|
Nn |
|
||||
|
|
|
|
|
|
|
N A |
|
|
N A |
|
|
|
N A |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
н |
m1 |
|
|
m2 |
|
|
|
mi |
|
|
|
|
|
|
|
|
mn |
, |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
м1 |
|
|
м2 |
|
|
мi |
|
|
|
|
|
|
|
мn |
|||||||
где |
i , |
i , mi , i – соответственно количество вещества, число молекул, мас- |
||||||||||||||||||||||
са, молярная масса i – ой компоненты системы ( i |
1,2,3...,n ). |
|||||||||||||||||||||||
|
1.2. Молярная масса смеси газов: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
м |
|
|
m1 |
m2 |
|
|
|
|
mn |
, |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
1 |
|
2 |
|
|
|
|
|
|
n |
|
|
|
|
|
||||||
где mi |
– масса i – го компонента смеси; i |
|
mi |
|
– количество вещества i -го |
|||||||||||||||||||
|
|
|
i |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
компонента, n – число компонентов смеси.
3

1.3. Массовая доля i i – го компонента смеси газа (в долях единицы или процентах):
i mmi ,
где m – масса смеси; mi – масса i – го компонента.
1.4. Концентрация молекул: |
|
|
|
|
|
|
n |
Н |
|
Н |
|
N |
, |
|
|
|
|
|
||
V |
|
V |
|
|
||
|
|
|
|
|
||
где Н – число молекул, содержащихся в объеме V системы; V – объем одно-
– объем одно-
го моля (V );  – плотность вещества.
– плотность вещества.
Формула справедлива не только для газов, но и для любого агрегатного состояния вещества.
1.5. Уравнение состояния идеального газа (уравнение Менделеева - Клапейрона):
PV |
m |
RT |
или |
PV |
RT , |
|
|||||
|
м |
|
|
|
|
где m – масса газа; – молярная масса газа; R |
8,31 Дж моль К – моляр- |
||||
ная (универсальная) газовая постоянная; Ф – термодинамическая температура;
–количество вещества.
1.6.Опытные газовые законы, являющиеся частными случаями уравнения Менделеева-Клапейрона для изопроцессов:
закон Бойля-Мариотта (изотермический процесс, Ф const , m const ):
PV |
const |
|||||||||||
или для двух состояний газа |
|
|
|
|
|
|
|
|
|
|||
PV |
|
P V ; |
||||||||||
1 |
1 |
|
|
2 |
2 |
|||||||
закон Гей-Люссака (изобарический процесс, P const , m const ): |
||||||||||||
|
|
|
V |
|
|
const |
||||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
T |
||||||||
|
|
|
|
|
|
|
|
|
||||
или для двух состояний |
|
|
|
|
|
|
|
|
|
|||
|
|
V1 |
|
|
|
V2 |
; |
|||||
T1 |
T2 |
|||||||||||
|
|
|
|
|
||||||||
закон Шарля (изохорический процесс, V const , m const ): |
||||||||||||
|
P |
|
|
|
|
const |
||||||
|
|
|
|
|
|
|
||||||
|
T |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|||
или для двух состояний |
|
|
|
|
|
|
|
|
|
|||
|
|
P |
|
|
P |
|
|
|||||
|
|
|
1 |
|
|
|
2 |
. |
||||
|
|
|
|
|
|
|
||||||
|
|
T1 |
|
|
T2 |
|
|
|||||
1.7. Зависимость давления от концентрации молекул и температуры:
P n k T ,
4

где k R Н
Н 1,38 10 23 Дж
1,38 10 23 Дж К – постоянная Больцмана; n – концентрация
К – постоянная Больцмана; n – концентрация
молекул; T – термодинамическая температура.
1.8. Закон Дальтона – давление смеси идеальных газов равно сумме парциальных давлений входящих в неѐ газов:
СС1 С2 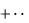
 Сn ,
Сn ,
где Сi – парциальное давление i – го компонента смеси; n – число компонен-
тов смеси.
Парциальное давление – давление, которое оказал бы компонент смеси, если бы он один занимал объем, равный объему смеси при той же температуре.
1.9. Барометрическая формула, выражающая убывание давления газа с высокой h над поверхностью Земли:
С |
С e gh RT , |
h |
0 |
где Сh – давление на высоте h ; С0 |
– давление на высоте h 0 ; Ф – абсолют- |
ная температура; g – ускорение свободного падения.
2. КИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗОВ
Основные понятия, законы и формулы
2.1. Средняя квадратичная скорость молекул:
|
|
υ2 |
υ2 |
υ2 |
|
|
|
2 1 |
|
υкв |
1 |
2 |
N |
; |
υкв |
|
|
||
|
|
Ν |
|
N |
|||||
|
|
|
|
|
|
|
|
||
Nυi 2 ,
i1
где хi i 1,2...N – скорость i -ой молекулы, Н – число молекул. 2.2. Основное уравнение кинетической теории газов:
С |
1 |
nm х |
2 |
или |
Ρ |
|
2 |
n ε |
|
, |
|
|
кв |
|
|
пост |
|||||||
|
3 |
0 |
|
|
3 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
где С – давление газа; |
n – число молекул в единице объема (концентрация |
||||||||||
|
|
|
|
|
m0 |
2 |
|
|
|
||
молекул); m0 – масса одной молекулы; |
εпост |
υкв |
– средняя кинетическая |
||||||||
|
2 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||
энергия поступательного движения одной молекулы.
2.3. Зависимость средней кинетической энергии поступательного движения молекул от температуры:
ε |
|
|
3 |
k , |
|
пост |
2 |
||||
|
|
||||
|
|
|
|||
где k – постоянная Больцмана. |
|
|
|
|
|
2.4. Число степеней свободы i |
– это число независимых величин, с по- |
||||
мощью которых может быть задано положение тела или частицы в пространстве.
Положение тела или частицы в пространстве определяется шестью независимыми координатами: тремя линейными ( x, y, z ), определяющих положе-
ние центра массы тела или частицы, и тремя угловыми ( б, в, г ), определяющих
5

положение трех взаимно перпендикулярных осей, проходящих через центр масс тела или частицы.
Если тело перемещается в пространстве совершенно произвольно, то это перемещение всегда можно составить из шести одновременно независимых движений: трех поступательных (вдоль трех осей системы координат) и трех вращательных (вокруг трех взаимно перпендикулярных осей, проходящих через центр масс тела или частицы).
Следовательно, число степеней свободы – это число независимых возможных перемещений тела или частицы в пространстве.
У идеального газа:
одноатомная молекула имеет i 3 степени свободы (молекулу одноатомного газа рассматривают как материальную точку, которой приписывают три степени свободы поступательного движения);
жесткая двухатомная молекула имеет i 5 степеней свободы (три поступательных и две вращательных, вращение вокруг оси молекулы для материальных точек лишено смысла);
молекула из трех – и более жестко связанных атомов имеет i 6 степеней свободы (три поступательных и три вращательных, подобно абсолютно твердому телу).
Если молекула упругая, то возможны колебания атомов в молекуле и необходима ещѐ одна степень свободы. Еѐ называют колебательной. При этом на колебательную степень свободы должны приходиться в среднем по две половинки k – одна в виде кинетической и одна в виде потенциальной энергии (их средние значения одинаковы).
Тогда
i  Ζпост
Ζпост 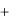 Ζвр 2Ζкол ,
Ζвр 2Ζкол ,
где i – сумма числа поступательных ( Ζпост ), вращательных ( Ζвр ) и удвоенного числа колебательных ( Ζкол ) степеней свободы.
2.5. Средняя кинетическая энергия: приходящаяся на одну степень свободы
ε |
|
1 |
k ; |
|
1 |
2 |
|||
|
|
|||
|
|
|
приходящаяся на все степени свободы молекулы
ε |
|
i |
k , |
|
0 |
2 |
|||
|
|
|||
|
|
|
где k – постоянная Больцмана, Ф – термодинамическая температура; i – число степеней свободы молекулы.
6

3. СТАТИСТИЧЕСКАЯ ФИЗИКА. РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА И БОЛЬЦМАНА
Основные понятия, законы и формулы
3.1. Вероятность. Средние значения.
Статистическая физика – это раздел физики, в котором изучают свойства макросистем, исходя из индивидуальных свойств составляющих макросистему частиц и взаимодействий между ними. Описание движения каждой частицы макросистемы (системы, образованной огромным количеством молекул) – задача совершенно немыслимая. Вместо этого статистическая физика оперирует со средними значениями параметров очень большого числа частиц.
Основу статистической физики составляет теория вероятностей. Вероятность интересующего нас события характеризуется кратностью его повторения. Если в Н случаях i -ое событие происходит Нi раз, то вероятностью Сi
этого события называют величину
Сi ННi .
Для вычисления вероятности необходимо,чтобы Н и Нi были достаточно
большими.
Сумма вероятностей всех возможных результатов равна единице:
Сi |
Ni |
1. |
|
N |
|||
|
|
Зная вероятности появления различных результатов измерения дискретной величины x , можно найти их среднее значение  x
x . По определению среднего
. По определению среднего
x |
1 |
|
Нi xi |
Сi xi . |
|||
|
|
|
|||||
|
Н |
||||||
|
|
|
|
|
|
||
3.2. Распределение Максвелла – закон распределения по скоростям мо- |
|||||||
лекул газа, находящегося в термодинамическом равновесии. |
|||||||
Вероятность или относительное число молекул, модуль скорости кото- |
|||||||
рых заключен в интервале х, х |
|
dх : |
|
|
|
|
|
|
|
|
dС |
|
dН |
. |
|
|
|
|
|
|
|
||
|
|
|
|
|
Н |
|
|
Плотность вероятности |
f х или относительное число молекул, модуль |
||||||
скорости которых заключен в единичном интервале скоростей, выбранном около конкретной скорости х :
f |
х |
|
dС |
|
dН |
. |
|
|
|
||||
|
|
|
dх Нdх |
|||
Плотность вероятности f |
х |
есть функция скорости, которая и пред- |
||||
ставляет собой закон распределения Максвелла по модулю скорости:
7

|
|
|
|
|
|
m |
3 2 |
m х2 |
|
|
|
|
|
|
|
|
х2 exp |
|
|||
|
|
|
f |
х |
4р |
|
0 |
0 |
. |
|
|
|
|
2рkT |
2kT |
||||||
|
|
|
|
|
|
|
|
|||
|
Вид функции |
f |
х показан на рис.1. Площадь под кривой функции |
|||||||
f х |
в заданном интервале скоростей |
|
|
|||||||
х1; х2 |
равна вероятности этих скоро- |
|
|
|||||||
стей |
|
|
|
|
|
|
|
|
|
|
|
|
Н |
2 |
|
|
|
|
|
|
|
|
С |
|
f х dх . |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
|
Н |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
Функция Максвелла нормирована |
|
|
|||||||
на единицу: |
|
|
|
|
|
|
|
|
|
|
|
С |
f х dх |
1, |
|
|
|
|
|
||
|
|
0 |
|
|
|
|
|
|
|
Рис. 1 |
т.е. полная площадь под кривой |
f |
х |
|
|||||||
|
|
|||||||||
равна единице. |
|
|
|
|
|
|
|
|
|
|
Замечания. |
|
|
|
|
|
|
|
|
|
|
1. Следует отметить, что полученное Максвеллом распределение по скоростям не зависит ни от структуры молекул, ни от того, как они взаимодействуют друг с другом. Поэтому оно применимо не только к газам, но и к другим агрегатным состояниям вещества.
2. При подсчете вероятности в заданном интервале скоростей не всегда следует прибегать к интегрированию. Если интервал очень мал (по сравнению с самой скоростью), то решение сводится просто к умножению:
P  f
f  .
.
3.3. Характерные скорости газовых молекул:
наиболее вероятная скорость – скорость, которой соответствует макси-
мум функции распределения |
f х : |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
хв |
2 |
|
kT |
|
|
|
|
|
2 |
RT |
|
|
; |
|
|
|
|
|||||||
|
m0 |
|
м |
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
средняя арифметическая скорость: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
х |
х f х dх |
8kT |
|
|
|
8 RT |
; |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
рm0 |
|
|
|
р м |
|||||||||||||||||||||
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
средняя квадратичная скорость: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
хкв |
3 |
kT |
|
|
|
3 |
RT |
. |
|
|
||||||||||||||
|
m0 |
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
м |
|
|
|
|
|
|
|
||||||||
3.4. Формула Максвелла в приведенном виде.
Решение ряда задач удобнее проводить, если выражать скорости х в относительных единицах – единицах наиболее вероятной скорости хв . Тогда от-
носительная скорость молекулы u х хв .
хв .
8

При переходе к новой переменной распределение Максвелла примет вид:
|
|
|
|
|
f u |
|
|
|
|
u2 exp |
u2 . |
|
|
|
|
|||
|
|
|
|
|
4 |
|
|
р |
|
|
|
|
||||||
3.5. Закон Максвелла для распределения молекул идеального газа по ки- |
||||||||||||||||||
нетическим энергиям поступательного движения: |
|
|
|
|
||||||||||||||
|
|
|
|
dN е |
|
|
|
|
|
|
3 2 е1 2 exp |
е kT , |
|
|||||
|
f |
е |
|
2 |
р kT |
|
||||||||||||
|
|
|
|
|
|
|||||||||||||
|
|
Ndе |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
где функция f |
определяет относительное число молекул dN |
N из обще- |
||||||||||||||||
го числа N молекул, которые имеют кинетические энергии, |
заключенные в |
|||||||||||||||||
интервале от |
до |
|
d . |
|
|
|
|
|
|
|
|
|
|
|
|
|||
3.6. Распределение Больцмана во внешнем потенциальном поле: |
||||||||||||||||||
|
|
|
|
|
м g h |
|
|
m gh |
|
|
|
е р |
|
|||||
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
n |
|
n e RT |
n e |
|
|
kT |
или |
n n e |
kT , |
|
|||||||
|
|
|
0 |
|
|
|
0 |
|
|
|
|
|
|
|
0 |
|
|
|
где n и n0 – концентрации молекул на высоте h и h |
0 ; |
е р – потенциальная |
||||||||||||||||
энергия молекулы во внешнем силовом поле (в поле силы тяжести е р m0 gh ).
4. ЯВЛЕНИЯ ПЕРЕНОСА
Основные понятия, законы и формулы
4.1. Среднее число столкновений, испытываемых одной молекулой в единицу времени:
 z
z

 2πd 2 n
2πd 2 n  υ
υ ,
,
где d – эффективный диаметр молекулы; n – концентрация молекул; |
υ |
–средняя арифметическая скорость молекул.
4.2.Средняя длина свободного пробега молекулы газа  л
л (путь, кото-
(путь, кото-
рый в среднем проходят молекулы между двумя последовательными столкновениями):
λ |
υ |
1 |
kT |
|
z |
2πd 2 n |
2πd 2 P . |
||
|
4.3. Диффузия. Закон Фика.
Явление диффузии в простейшем одномерном случае в химически однородном газе возникает, когда плотность (либо концентрация) зависит только от одной координаты x , при этом перенос вещества осуществляется только вдоль оси ox и подчиняется закону Фика:
dm 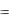 D ddρx dS dt ,
D ddρx dS dt ,
где dm – масса вещества, диффундирующего за время dt через площадку dS ,
расположенную перпендикулярно направлению переноса вещества; ddx – гра-
диент плотности вдоль оси ox ; D – коэффициент диффузии.
9

Плотность потока массы jm – масса, переносимая в единицу времени через единицу площади в направлении нормали к этой площадке в сторону
убывания плотности: j D dρ .
m |
dx |
|
4.4. Явление теплопроводности. Закон Фурье.
Явление теплопроводности в простейшем одномерном случае возникает в веществе, температура которого зависит только от одной координаты x , при этом перенос внутренней энергии путем теплообмена осуществляется только вдоль оси ox и описывается законом Фурье:
dQ 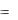 K ddTx dS dt ,
K ddTx dS dt ,
где dQ – количество теплоты, которое передается вследствие теплопроводно-
сти за время dt через площадку dS , расположенную перпендикулярно направлению переноса внутренней энергии; K – коэффициент теплопроводности
(теплопроводность); dT – градиент температуры вдоль оси ox . dx
Плотность теплового потока jQ – количество теплоты, переносимое в
единицу времени через единицу площади в направлении нормали к площадке: jQ  K ddTx .
K ddTx .
4.5. Явление внутреннего трения (вязкости). Закон Ньютона.
Явление вязкости возникает в тех случаях, когда на хаотическое тепловое движение молекул накладывается упорядоченное движение. В этом явлении через площадку S происходит перенос импульса в направлении, перпендикулярном соприкасающимся слоям:
dp  η dduz S dt .
η dduz S dt .
Внутреннее трение (вязкость) связано с возникновением сил трения между слоями газа или жидкости, перемещающимися параллельно друг другу с разными по модулю скоростями u . Силы трения, которые при этом возникают, направлены по касательной к поверхности соприкасающих слоев. Для явления внутреннего трения справедлив закон Ньютона:
F η dduz S ,
где F – касательная силы трения, действующая на
поверхность слоя площадью S ; du – градиент ско- dz
рости течения газа (жидкости) в направлении внешней нормали n к поверхности слоя (рис. 2); 
– коэффициент внутреннего трения (динамическая вязкость).
Рис.2
Плотность потока импульса:
10
