
РАЗНОЕ3 / физика или химия.....а может и то и другое
.RTF
1 моль H2 1 моль O2 1 моль Br2(г) 1 моль N2
Для обоснования ответа используйте справочные данные.
-
Приведите и обоснуйте выражения для расчета изменения энтропии и изменения энергии Гиббса при обратимых изотермических фазовых переходах первого рода. Приведите примеры таких фазовых превращений.
-
Дайте определение понятия «химический потенциал». Перечислите основные свойства химического потенциала. Приведите выражение для зависимости химического потенциала чистого идеального газа от давления при постоянной температуре.
-
Сформулируйте критерии самопроизвольности процессов и равновесия в системах переменного состава. Что является движущей силой диффузионного массопереноса в таких системах?
-
Расположите приведённые системы в порядке возрастания химического потенциала некоторого идеального газа:
а) чистый идеальный газ в количестве 2 моль при давлении 0.5 атм и температуре 300К;
б) тот же газ в эквимолярной идеальной смеси с другим газом при температуре 300К и общем давлении 0.5 атм;
в) чистый идеальный газ в количестве 0.5 моль при давлении 2 атм и температуре 300К;
г) тот же газ в эквимолярной идеальной смеси с другим газом при температуре 300К и общем давлении 2 атм. Приведите обоснование ответа.
-
Для какой из приведенных ниже реакций стандартная энергия Гиббса будет быстрее изменяться с ростом температуры вблизи 298К:
а) синтез 1 моль газообразного аммиака;
б) образование газообразного хлороводорода из простых веществ;
в) окисление меди до CuO?
Для обоснования ответа используйте справочные данные.
-
Проанализируйте температурные зависимости энтропии и энергии Гиббса в окрестности фазового перехода первого рода при P=const. Какой смысл будут иметь в каждом случае температурные производные указанных функций?
-
В интервале 298-353 К теплоемкость воды можно принять независящей от температуры. Справедливо ли утверждение, что энергия Гиббса и энтропия воды будут линейно изменяться с температурой? Приведите объяснение.
-
Запишите и проанализируйте уравнение температурной зависимости стандартного изменения энергии Гиббса в химической реакции в дифференциальной форме. Приведите пример реакции, для которой стандартное изменение энергии Гиббса уменьшается с ростом температуры. Дайте обоснование ответа.
-
Запишите и проанализируйте уравнение температурной зависимости стандартного изменения энергии Гиббса в химической реакции в дифференциальной форме. Приведите пример реакции, для которой стандартное изменение энергии Гиббса увеличивается с ростом температуры. Дайте обоснование ответа.
-
Выведите выражение для первой частной производной энтальпии индивидуального вещества по давлению. В каких системах влияние давления на энтальпию выражено наиболее сильно? В каких случаях этим влиянием можно пренебречь?
Типы задач
-
Расчет изменения энергии Гиббса и изменения энергии Гельмгольца в обратимых изотермическом, изобарном или изохорном процессах с участием идеальных газов и в циклах, составленных из таких процессов.
-
Расчет изменения энергии Гиббса при смешивании двух идеальных газов.
-
Составление (вывод) выражений температурной зависимости стандартного изменения энергии Гиббса в химической реакции с использованием стандартных термодинамических величин для веществ при 298К и температурной зависимости теплоемкости.
-
Расчет стандартного изменения энергии Гиббса (вариант: стандартного химического сродства) и стандартного изменения энергии Гельмгольца в химической реакции при заданной температуре.
Химическое равновесие – материальный баланс и равновесный состав системы
Вопросы
-
Дайте определение химической переменной. Покажите взаимосвязь химической переменной и степени превращения реагента в реакции 2NO2 = 2NO + O2, для которой в начале опыта было взято 4 моль NO2, а равновесная степень диссоциации NO2 составила 25%.
-
Для реакции MgCO3(тв) = MgO(тв) + CO2(г) запишите выражения для термодинамической константы равновесия, выразив ее через активности компонентов, существующих в виде конденсированных фаз, и парциальные давления (летучести) газообразных участников реакции.
-
Приведите пример газофазной химической реакции, равновесие в которой при увеличении давления смещается в сторону продуктов реакции. Пример обоснуйте анализом соответствующих уравнений.
-
Приведите пример газофазной химической реакции, равновесие в которой при увеличении давления смещается в сторону исходных веществ. Пример обоснуйте анализом соответствующих уравнений.
-
Приведите пример газофазной химической реакции, равновесие в которой при изобарном разбавлении смеси инертным газом смещается в сторону продуктов реакции. Пример обоснуйте анализом соответствующих уравнений.
-
Приведите пример газофазной химической реакции, равновесие в которой при изобарном разбавлении смеси инертным газом смещается в сторону исходных веществ. Пример обоснуйте анализом соответствующих уравнений.
-
В каком случае термодинамическая константа равновесия численно совпадает с эмпирическими константами равновесия, выраженными через равновесные мольные доли или парциальные давления участников реакции? Приведите пример соответствующей реакции. Какие факторы и как влияют на состав равновесной смеси в этой реакции? Дайте пояснения к ответу.
-
Запишите уравнение связи термодинамической константы равновесия с эмпирической константой равновесия, выраженной через равновесные молярные концентрации, для реакции в идеальной газовой смеси. Могут ли эти константы равновесия совпадать по величине, если да, то при каком условии? Приведите пример и дайте обоснование.
-
Как взаимосвязаны между собой эмпирические константы равновесия, выраженные через равновесные молярные концентрации и через парциальные давления? Установите соотношение между ними для химической реакции CH4 + 2H2O = CO2 + 4H2 , протекающей в идеальной газовой смеси? Какая из названных констант в данном случае больше?
-
Запишите уравнение связи термодинамической константы равновесия с эмпирической константой равновесия, выраженной через равновесные мольные доли, для реакции в идеальной газовой смеси. Могут ли эти константы равновесия совпадать по величине, если да, то в каком случае? Приведите пример и обоснование ответа.
-
Для проведения газофазной реакции CO+H2O(г)=H2+CO2 взяты 2 моль CO, 1 моль H2O, 0.5 моль H2, и 0.5 моль CO2, а в результате реакции после достижения равновесия в системе дополнительно образовалось y моль H2, общее давление равновесной газовой смеси равно P. Представьте выражение для константы равновесия КP реакции относительно величин y и P. Газовую смесь считайте идеальной.
-
В гомогенной системе протекает следующая химическая реакция:
4HCl(г) + O2 = 2H2O(г) + 2Cl2
Общее давление равновесной газовой смеси равно P, равновесный выход Cl2 обозначен как y моль, а начальные количества взятых для реакции веществ составляют 4 моль HCl и 1 моль H2. Продукты реакции в момент её начала в системе отсутствовали. Выведите выражение для константы равновесия KP данной реакции относительно y и P. Газы считайте идеальными.
-
В двух независимых системах при температуре 700К в идеальной газовой фазе протекают реакции диссоциации:
2HCl(г) = H2 + Cl2
2H2O(г) = 2H2 + O2
Изменится ли степень диссоциации HCl и H2O при увеличении общего давления? Влияет ли повышение температуры на равновесный выход водорода в этих реакциях? Приведите объяснение.
-
При окислении сернистого газа SO2 + ЅO2 = SO3 (г) при заданных давлении и температуре в реакторе присутствует также азот. Как присутствие азота изменит равновесный выход продукта по сравнению с реакцией окисления SO2 кислородом без примеси азота при том же общем давлении смеси? Приведите объяснение. Все газы считайте идеальными.
-
Триоксид серы диссоциирует в газовой фазе в соответствии с уравнением 2SO3(г) = 2SO2(г) + O2(г). Выразите константу равновесия KP данной реакции через равновесную степень диссоциации a и общее давление смеси P. Газовую смесь считайте идеальной.
-
При изменении температуры от 500 К до 800 К при постоянном давлении увеличился равновесный выход CO в реакции COCl2(г) = CO(г) + Cl2(г). Выделяется или поглощается теплота в ходе данной реакции? Влияет ли изменение общего давления при T = const на равновесие в данной реакции? Дайте обоснованный ответ.
-
Для экзотермической реакции в идеальной газовой фазе CO + H2O(г) = H2 + CO2 при температуре 800К и давлении 1 атм изменение энтальпии составляет –37,5 кДж, а термодинамическая константа равновесия равна 4,12. Возможно ли добиться увеличения выхода водорода изменением условий проведения реакции (давления и температуры)? Дайте обоснованный ответ.
-
Для экзотермической реакции в идеальной газовой фазе С2H4(г) + H2O(г) = C2H5OH(г), стандартный тепловой эффект при температуре 600К равен –47,3кДж. Возможно ли добиться увеличения выхода этанола изменением условий проведения реакции (давления и температуры)? Дайте обоснованный ответ.
-
Какие из факторов: общее давление, температура, присутствие инертного газа, и как влияют на степень диссоциации HBr по реакции 2HBr(г) = H2 + Br2(г). Реакция протекает в идеальной газовой фазе. Приведите обоснование ответа.
-
Используя метод комбинирования уравнений химических реакций, выразите термодинамическую константу равновесия реакции CH4 + 2H2O(г) = 4H2 + CO2
через константы равновесия Ka,1 – Ka,3 следующих реакций
CH4 = C + 2H2 (Ka,1)
CO + H2 = C + H2O (Ka,2)
2CO = C + CO2 (Ka,3)
Углерод присутствует в твердом состоянии в виде графита, остальные вещества – идеальные газы. Влияет ли изменение общего давления при постоянной температуре на равновесный выход водорода в данной реакции?
Типы задач
-
Расчет значений констант равновесия KP и KC для реакций в идеальной газовой смеси по данным о равновесном составе смеси или о равновесной степени превращения при заданных условиях.
-
Расчет равновесной степени превращения и равновесных концентраций веществ для химической реакции в идеальной системе по заданному значению константы равновесия (для гомогенных реакций в идеальной газовой смеси и для гетерогенных реакций в системах, включающих идеальный газ и практически чистые вещества в конденсированной фазе).
-
Определение направления самопроизвольного протекания реакции при P=const, T=const с использованием уравнения изотермы Вант-Гоффа.
Химическое равновесие, уравнения изотермы и изобары
Вант-Гоффа, химическое сродство
Вопросы
-
Выведите уравнение изотермы химической реакции (изотермы Вант-Гоффа), для процесса при постоянных давлении и температуре. Проанализируйте данное уравнение, указав условия самопроизвольного протекания прямой или обратной реакций, а также условие равновесия. Назовите все используемые величины.
-
Запишите уравнение изотермы Вант-Гоффа для химической реакции Ca(тв) + 2H2O(г) = Ca(OH)2(тв) + H2(г), в которой участвуют идеальные газы и практически чистые вещества в твёрдой смеси. Приведите варианты уравнения для случаев начала реакции и равновесия. Запишите выражение термодинамической константы равновесия данной реакции.
-
Запишите уравнение изобары химической реакции (изобары Вант-Гоффа). Проиллюстрируйте различные варианты температурной зависимости константы равновесия графиком в координатах
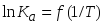 .
Объясните наклон и кривизну линий на
этом графике. Назовите все используемые
величины.
.
Объясните наклон и кривизну линий на
этом графике. Назовите все используемые
величины. -
Запишите уравнение изобары Вант-Гоффа для химической реакции CaCO3(тв) = CaO(тв) + CO2(г), проанализируйте влияние температуры на равновесие в реакции. Приведите схематический график температурной зависимости константы равновесия (в координатах, позволяющих определить энтальпию реакции).
-
Изобразите схематически график температурной зависимости константы равновесия в координатах
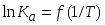 для случая эндотермической реакции,
тепловой эффект которой возрастает с
повышением температуры (
для случая эндотермической реакции,
тепловой эффект которой возрастает с
повышением температуры (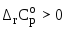 ).
Ответ обоснуйте уравнениями, описывающими
вид показанной линии. Покажите, как с
помощью этого графика рассчитать
значение теплового эффекта реакции
при некоторой температуре T1.
).
Ответ обоснуйте уравнениями, описывающими
вид показанной линии. Покажите, как с
помощью этого графика рассчитать
значение теплового эффекта реакции
при некоторой температуре T1. -
Изобразите схематически график температурной зависимости константы равновесия в координатах
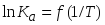 для случая экзотермической реакции,
тепловой эффект которой убывает с
повышением температуры (
для случая экзотермической реакции,
тепловой эффект которой убывает с
повышением температуры (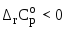 ).
Ответ обоснуйте уравнениями, описывающими
вид показанной линии. Покажите, как с
помощью этого графика рассчитать
значение теплового эффекта реакции
при некоторой температуре T1.
).
Ответ обоснуйте уравнениями, описывающими
вид показанной линии. Покажите, как с
помощью этого графика рассчитать
значение теплового эффекта реакции
при некоторой температуре T1. -
Выведите выражение для температурной зависимости термодинамической константы равновесия экзотермической реакции, изменение теплоемкости в которой равно нулю. Изобразите схематически график этой зависимости в координатах
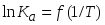 и поясните метод расчета теплового
эффекта реакции с использованием данных
выражения и графика.
и поясните метод расчета теплового
эффекта реакции с использованием данных
выражения и графика. -
Приведите пример химической реакции, равновесие в которой при увеличении температуры смещается в сторону продуктов. Пример обоснуйте анализом соответствующих уравнений.
-
Приведите пример химической реакции, равновесие в которой при увеличении температуры смещается в сторону исходных веществ. Пример обоснуйте анализом соответствующих уравнений.
-
Для реакции в идеальной газовой смеси 2А+В=С при некоторой температуре экспериментально определен состав равновесной смеси. Он был охарактеризован значениями парциальных давлений реагентов PA и PB и общим давлением газовой смеси P, выраженными в Па. Укажите, какие операции с опытными данными следует выполнить, чтобы рассчитать экспериментальную величину стандартного химического сродства.
-
Для реакции в идеальной газовой смеси 2А+В=2С, происходящей при некоторой температуре Т в сосуде объема V, экспериментально был определен состав равновесной смеси. Он был охарактеризован значениями чисел молей каждого из реагентов. Укажите, какие операции с опытными данными следует выполнить, чтобы вычислить экспериментальную величину стандартного химического сродства.
-
Для реакции в идеальной газовой смеси 2А+В=С+D, происходящей при некоторой температуре Т в сосуде объема V, экспериментально был определен состав равновесной смеси. Он был охарактеризован значениями молярных концентраций (моль/л) каждого из реагентов и общим давлением газовой смеси. Приняв во внимание, что продукты в момент начала реакции в смеси отсутствовали, укажите, какие операции с опытными данными следует выполнить, чтобы определить экспериментальную величину стандартного химического сродства.
-
Для реакции в идеальной газовой смеси А+В=2С+D, происходящей при некоторой температуре Т в сосуде объема V, экспериментально был определен состав равновесной смеси. Он был охарактеризован значениями мольных долей каждого из реагентов и общим количеством вещества в газовой смеси. Укажите, какие операции с опытными данными следует выполнить, чтобы вычислить экспериментальную величину стандартного химического сродства.
-
Запишите выражения, обосновывающие метод расчета термодинамической константы равновесия по справочным данным о стандартной приведенной энергии Гиббса веществ и о стандартной энтальпии образования веществ при T® 0К. Укажите ограничения применимости данного метода.
-
Запишите выражения, обосновывающие метод расчета термодинамической константы равновесия по справочным данным о логарифмах констант равновесия реакций образования веществ из простых веществ. Приведите итоговое выражение для реакции CuCl2(тв)=CuCl(тв)+1/2Cl2.
-
Для некоторой химической реакции температурная зависимость стандартного изменения энергии Гиббса выражается уравнением:
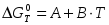 ,
где A
и B
– эмпирические постоянные. Выведите
выражения для температурных зависимостей
термодинамической константы равновесия,
стандартного изменения энтропии,
стандартного изменения энтальпии и
изменения теплоемкости в ходе реакции.
,
где A
и B
– эмпирические постоянные. Выведите
выражения для температурных зависимостей
термодинамической константы равновесия,
стандартного изменения энтропии,
стандартного изменения энтальпии и
изменения теплоемкости в ходе реакции. -
Для некоторой химической реакции температурная зависимость термодинамической константы равновесия выражается уравнением:
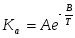 ,
где A
и B
– эмпирические постоянные. Выведите
выражения для температурных зависимостей
стандартного изменения энергии Гиббса,
стандартного изменения энтропии,
стандартного изменения энтальпии и
изменения теплоемкости в ходе реакции.
,
где A
и B
– эмпирические постоянные. Выведите
выражения для температурных зависимостей
стандартного изменения энергии Гиббса,
стандартного изменения энтропии,
стандартного изменения энтальпии и
изменения теплоемкости в ходе реакции. -
Для некоторой химической реакции температурная зависимость стандартного изменения энергии Гиббса выражается уравнением:
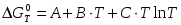 ,
где A,
B,
С
– эмпирические постоянные. Выведите
выражения для температурных зависимостей
термодинамической константы равновесия,
стандартного изменения энтропии,
стандартного изменения энтальпии и
изменения теплоемкости в ходе реакции.
,
где A,
B,
С
– эмпирические постоянные. Выведите
выражения для температурных зависимостей
термодинамической константы равновесия,
стандартного изменения энтропии,
стандартного изменения энтальпии и
изменения теплоемкости в ходе реакции. -
Выведите уравнение температурной зависимости термодинамической константы равновесия экзотермической реакции, для которой изменение теплоемкости при температурах T > 298К положительно и приблизительно постоянно. Изобразите схематически соответствующий график зависимости логарифма термодинамической константы равновесия реакции от обратной температуры, назовите все используемые величины.
-
Выведите уравнение температурной зависимости термодинамической константы равновесия эндотермической реакции, для которой изменение теплоемкости при температурах T > 298К положительно и линейно возрастает с ростом температуры. Изобразите схематически соответствующий график зависимости логарифма термодинамической константы равновесия реакции от обратной температуры, назовите все используемые величины.
Типы задач
-
Расчет константы равновесия химической реакции при данной температуре по ее значению при другой температуре и среднему изменению энтальпии в данном интервале температур.
-
Вывод уравнений для температурных зависимостей стандартных изменений энтальпии, энтропии, энергии Гиббса и теплоемкости для химической реакции по температурной зависимости термодинамической константы равновесия. Расчет любой из названных величин при заданной температуре.
-
Расчет термодинамической константы равновесия и стандартного изменения энергии Гиббса (энергии Гельмгольца) химической реакции по справочным данным методом Темкина-Шварцмана.
-
Расчет термодинамической константы равновесия и стандартного изменения энергии Гиббса (энергии Гельмгольца) химической реакции по справочным данным о константах равновесия реакций образования веществ из простых веществ.
-
Расчет термодинамической константы равновесия и стандартного изменения энергии Гиббса (энергии Гельмгольца) химической реакции в идеальной газовой смеси по справочным данным о стандартной приведенной энергии Гиббса веществ в состоянии идеального газа и о стандартной энтальпии образования.
-
Расчет равновесного давления газообразного продукта гетерогенной реакции, в которой участвуют практически чистые вещества в конденсированных фазах и образуется идеальный газ (предполагается предварительный расчет константы равновесия по справочным термодинамическим данным – задачи типов 3, 4).
-
Составление (вывод) выражений температурной зависимости термодинамической константы равновесия в химической реакции с использованием стандартных термодинамических величин для веществ при 298К и температурной зависимости теплоемкости.
Фазовое равновесие в однокомпонентных системах
Вопросы
-
Изобразите диаграмму фазового состояния однокомпонентной системы в координатах P-T. Охарактеризуйте все фазовые поля, линии и точки на диаграмме. Какое наибольшее число фаз может находиться в равновесии в однокомпонентной системе?
-
Изобразите схематически P-T-диаграмму состояния однокомпонентной системы, в которой могут существовать газовая, твёрдая и жидкая фазы, причём последняя кристаллизуется с уменьшением объёма. Укажите фазовые поля, линии и особые точки диаграммы. Напишите и назовите уравнение, определяющее наклон линии плавления к оси абсцисс.
-
Изобразите диаграмму состояния однокомпонентной системы в координатах P-T, на которой линия плавления отклоняется влево от вертикали. На какое свойство компонента системы указывает эта особенность? Ответ обоснуйте анализом соответствующего термодинамического уравнения.
-
Плотность жидкого галлия больше плотности галлия в твердом состоянии. Возрастет или уменьшится температура плавления этого металла, если внешнее давление повысить на несколько сот атмосфер по сравнению с атмосферным давлением? Приведите схематическую P-T-диаграмму состояния для рассматриваемой системы, зная что в рассматриваемом интервале давлений твердый галлий существует в единственной кристаллической форме. Дайте обоснование ответа.
-
Изобразите схематически график, которым следует воспользоваться для определения средней энтальпии испарения индивидуальной жидкости в интервале температур T1-T2. Напишите соответствующую расчётную формулу и назовите все используемые величины. На каком более общем уравнении и на каких допущениях основан этот расчет?
-
Какую температуру называют температурой тройной точки? Отличается ли она от температуры плавления вещества при атмосферном давлении? Вычислите вариантность состояния (число степеней свободы) однокомпонентной системы в тройной точке. Покажите тройную точку на схематическом рисунке соответствующей диаграммы, приведите наименования фазовых полей и линий этой диаграммы.
-
Твёрдый CO2 в обиходе называют «сухим» льдом. Объясните это название. Проиллюстрируйте различие «сухого» льда CO2 и «обычного» льда H2O анализом схематических диаграмм состояния. Можно ли добиться того, чтобы твёрдый CO2 перестал бы быть «сухим» льдом, если да, то как?
-
Дайте определения температуры кипения индивидуальной жидкости и давления ее насыщенного пара. Запишите уравнение температурной зависимости давления насыщенного пара в приближении постоянства теплоты испарения в данном интервале температур. Изобразите схематически соответствующую линию на диаграмме состояния в координатах P-T.
-
Сформулируйте правило Трутона. При каких условиях справедливо это правило? Получите уравнение температурной зависимости давления насыщенного пара жидкости, для которой правило Трутона выполнялось бы в заданном интервале температур.
-
Запишите уравнение Клапейрона и преобразуйте его применительно к процессам парообразования или возгонки при невысоких давлениях. Назовите полученное уравнение, укажите соответствующие участки линий на схематической P-T- диаграмме состояния.
-
Как связаны теплоты испарения, сублимации и плавления индивидуального вещества в тройной точке? Приведите соответствующее уравнение и обоснуйте его. Существует ли аналогичная связь для изменения энтропии названных фазовых превращений? Запишите выражения для изменения энтропии.
-
Возрастает, уменьшается или остается постоянной энтальпия испарения вещества с повышением температуры? Представьте эту зависимость в графической форме. Какое значение будет иметь энтальпия парообразования при критической температуре?
-
Под давлением 26600 Па жидкие циклогексан и этилацетат кипят при одной и той же температуре. При нормальном давлении температура кипения циклогексана выше температуры кипения этилацетата. Какое из этих веществ имеет большую теплоту испарения? При обосновании ответа пар данных веществ вплоть до давления 1 атм можно считать идеальным газом.
-
Энтальпия парообразования индивидуального вещества зависит от температуры. Как учитывается эта зависимость при интегрировании уравнения Клапейрона-Клаузиуса и как она проявляется при графическом представлении данных о давлении насыщенного пара в координатах lnP – 1/T? Как пользуясь данным графиком можно рассчитать энтальпию парообразования?
-
Дайте определение давления насыщенного пара индивидуального вещества, изобразите соответствующие линии на P-Т диаграмме состояния. Покажите, как с помощью графика в координатах lnP – 1/T можно определить координаты тройной точки на P-Т диаграмме? Приведите график и обоснование.
-
Запишите уравнение Клапейрона и поясните с его помощью, почему тангенс угла наклона кривых сублимации и испарения в координатах P - T всегда положительный, тогда как в случае кривой плавления он может быть как больше, так и меньше нуля.
-
Поясните вследствие каких причин температурная зависимость давления насыщенного пара индивидуального вещества, будучи представленной в широком интервале температур в координатах
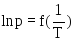 ,
может разделиться на два линейных
участка с разными наклонами. Какие
величины могут быть определены по
тангенсу угла наклона соответствующих
прямых в указанных координатах? Получите
выражение, связывающее между собой эти
величины для двух линейных участков.
,
может разделиться на два линейных
участка с разными наклонами. Какие
величины могут быть определены по
тангенсу угла наклона соответствующих
прямых в указанных координатах? Получите
выражение, связывающее между собой эти
величины для двух линейных участков. -
Выведите уравнение температурной зависимости давления насыщенного пара индивидуальной жидкости, если изменение теплоемкости при испарении в данном интервале температур отрицательно и линейно убывает с ростом температуры. Назовите все используемые величины. Пар считайте идеальным газом, состояние жидкости – далеким от критического.
-
Выведите уравнение температурной зависимости давления насыщенного пара индивидуальной жидкости, если изменение теплоемкости при испарении в данном интервале температур отрицательно и приблизительно постоянно. Назовите все используемые величины. Пар считайте идеальным газом, состояние жидкости – далеким от критического.
-
Сформулируйте принцип соответственных состояний, укажите, для описания каких систем он применяется. Запишите уравнение состояния Ван-дер-Ваальса, объясните, как в этом уравнении учитываются взаимное притяжение и собственный объем молекул. Запишите также вариант данного уравнения в приведенных параметрах. Назовите все используемые величины.
