
- •13.1. Общая характеристика процессов окисления
- •13.1.2. Деструктивное окисление с изменением углеродного скелета молекулы
- •13.1.3. Окисление, сопровождающееся связыванием молекул исходных реагентов (окислительная конденсация или окислительное сочетание
- •13.2. Окислительные агенты и техника безопасности в процессах окисления
- •13.3. Окисление по насыщенному атому углерода
- •13.3.1. Получение фенола и ацетона. Сравнительные характеристики методов получения фенола.
- •13.3.2. Окисление парафинов
- •13.3.3. Окисление циклоалканов и их производных
13.3.3. Окисление циклоалканов и их производных
Главное практическое значение этих процессов состоит в получении соответствующих циклических кетонов с размером цикла С5–С12и,-дикарбоновых кислот С5–С12. Среди циклических кетонов наибольшее значение иммет циклогексанон, представляющий собой жидкость с т.кип. 157оС, ограниченно растворимую в воде. Циклогексанон применяется в производстве капролактама, из которого получают синтетическое волокно капрон и важный коагулянт–-аминокапроновую кислоту.
Циклогексанон получают жидкофазным каталитическим окислением циклогексана кислородом воздуха в присутствии солей кобальта. Степень превращения циклогексана поддерживают на уровне 4-5%, чтобы предотвратить более глубокое окисление до адипиновой кислоты. В результате получают смесь циклогексанона и циклогексанола с выходом около 80%. Циклогексанол далее путем дегидрирования превращают в циклогексанон. Синтез циклогексанона может быть также осуществлен исходя из фенола и анилина по следующим схемам:


Эти схемы менее выгодны как с технологической, так и с экономической точки зрения.
Аналогичным образом получают циклопентанон.
Циклогексанон и циклопентанон используются для получения соответствующих лактамов. Наибольшее значение здесь имеет циклогексанон. Конденсацией циклогексанона с гидроксиламином получают оксим циклогексанона, который в условиях перегруппировки Бекмана превращается в капролактам:

Как уже говорилось выше, капролактам превращают в синтетическое волокно капронв результате реакции поликонденсации. Для химико-фармацевтической промышленности важен другой процесс: кислотный гидролиз капролактама, приводящий к-аминокапроновой кислоте:
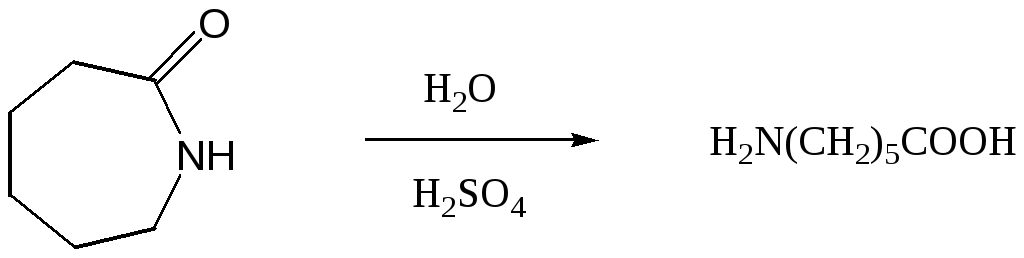
-аминокапроновая кислота, H2N(CH2)5COOH, C6H13NO2
Белый кристаллический порошок, т. пл. 372оС,хорошо растворим в спирте, воде, кислотах; нерастворим в метаноле и хлороформе. Обладает гемостатическим действием. Оказывает системный гемостатический эффект при кровотечениях, обусловленных повышенной фибринолитической активностью плазмы. Применяется в кардио- и сосудистой хирургии и различных оперативных вмешательствах. Лекарственные формы: растворы для внутривенного введения, таблетки.
Более глубокое окисление циклоалканов приводит к образованию ,-дикарбоновых кислот. Таким образом при окислении циклогексана кислородом воздуха в уксусной кислоте в присутствии ацетата кобальта при 80-100оС получаютадипиновую кислоту, а из циклопентана –глутаровую кислоту.
адипиновая кислота, НООС(СН2)4СООН, С6Н10О4
Бесцветное кристаллическое вещество, т.пл. 152оС, мало растворимое в холодной воде. Применяется для получения синтетического волокнанайлон 6,6и пластификаторов.
глутаровая кислота, НООС(СН2)3СООН, С5Н8О4
Бесцветное кристаллическое вещество, т.пл. 97.5оС, хорошо растворима в воде. Применяется в синтезе биологически активных веществ.
Н![]() изшие
дикарбоновые кислоты получают другими
способами, нежели окисление соответствующих
циклоалканов.Янтарная кислотаявляется одним из продуктов окисления
парафиновой фракции С5-С8.
Кроме того, ее можно получить из
1,2-дихлорэтана через соответствующий
динитрил, либо гидрированием малеинового
ангидрида с последующим гидролизом:
изшие
дикарбоновые кислоты получают другими
способами, нежели окисление соответствующих
циклоалканов.Янтарная кислотаявляется одним из продуктов окисления
парафиновой фракции С5-С8.
Кроме того, ее можно получить из
1,2-дихлорэтана через соответствующий
динитрил, либо гидрированием малеинового
ангидрида с последующим гидролизом:

янтарная кислота, НООС(СН2)2СООН, С4Н6О4
Бесцветное кристаллическое вещество, т.пл. 185оС, умеренно растворима в воде. Применяется в производстве инсектицидиов, лекарственных средств, алкидных смол и др. Соли янтарной кислоты называютсясукцинатами.
Щавелевая кислота образуется при окислении сахарозы или этиленгликоля
![]()
![]()
Еще одним методом получения щавелевой кислоты является быстрое нагревание (350оС) формиата натрия.
Щавелевая кислота, НООС-СООН, С2Н2О4
Бесцветное кристаллическое вещество, т.пл. 189.5оС, умеренно растворимо в воде. Содержится в щавеле в виде оксалата калия. Соли щавелевой кислоты называются оксалатами.
