
- •Введение
- •1. Физические основы цветности
- •1.1. Природа света и происхождение цветоощущения
- •Спектральный цвет
- •Дополнительный цвет
- •1.3. Взаимодействие электромагнитного излучения с веществом
- •1.3.1. Конфигурация электронно-колебательных уровней
- •1.3.2. Принцип Франка-Кондона и форма полос поглощения
- •2. Анализ электронной структуры методами квантовой химии.
- •2.1. Способы описания энергетических состояний молекул.
- •2.3. Формирование МО и основные типы электронных переходов
- •3. Экспериментальные методы изучения электронной структуры
- •3.1. Фотоэлектронная спектроскопия
- •3.2. Электронная трансмиссионная спектроскопия
- •4. Основные положения теории цветности
- •4.1.2. Энергии электронных переходов в сопряженных системах
- •4.2.1. Переходы в гетероцепных четных альтернантных системах
- •4.3.1. Классификация заместителей
- •4.3.2. Электронодонорные заместители
- •4.3.3. Электроноакцепторные заместители
- •4.3.4. Совместное действие поляризующих ЭД и ЭА заместителей
- •4.3.5. Полосы переноса заряда
- •4.4. Влияние ионизации на поляризующее действие заместителей
- •4.4.1. Ионизация ЭД-заместителей
- •4.4.2. Ионизация ЭА-заместителей
- •4.4.3. Ионизация сложных молекул
- •4.5.1. Разветвленные сопряженные системы
- •4.5.3. Перекрещивающиеся сопряженные системы
- •4.6. Влияние пространственных факторов на поглощение света
- •4.6.1. Нарушение копланарности сопряженной системы
- •4.6.2. Искажение валентных углов
- •4.7. Комплексообразование с металлами
- •4.7.1. Комплексообразование с углублением цвета
- •4.7.2. Комплексообразование без углубления цвета
- •5. Хромофорная система красителей
Теория цветности органических соединений |
66 |
В итоге, введение фенильного остатка как бы "подожмет" граничные МО друг к
другу. Энергии электронных переходов с ВЗМО на НВМО и 2-ЗМО на НВМО уменьшат-
ся, что приведет к батохромному сдвигу длинноволновой и коротковолновой полос. Коротковолновая полоса в спектре Малахитового зеленого оказывается в види-
мой части спектра и обусловливает желтую составляющую смешанного зеленого цвета этого красителя.
Из этих примеров следуют два простых правила.
Введение ЭД-заместителя в непомеченные положения НЧАС вызывает гипсохромный сдвиг полосы поглощения и повышение окраски красителя.
Введение заместителей, имеющих систему связывающих и разрыхляющих π-орбиталей (ЭА-заместители и карбоцепные сопряженные группы) в непомечен-
ные положения НЧАС вызывает батохромный сдвиг полос поглощения и углубление окраски красителя.
4.5.3. Перекрещивающиеся сопряженные системы
Если новый заместитель или новая сопряженная система присоединяются к молекуле в таком положении, что между ними и уже имеющимися заместителями или отдельными участками молекулы сопряжение невозможно, возникает перекрещи-
вающаяся сопряженная система.
Так при переходе от желтого |
моноазокрасителя (I) |
из сульфаниловой кислоты |
|||||||||||||
и резорцина к дисазокрасителю (II) – Кислотный светло-коричневый для кожи, в |
|||||||||||||||
последнем возникают две квазиавтономные π-системы. |
|
|
|
|
|
||||||||||
|
N N |
|
|
SO3H |
|
HO |
S |
|
N N |
N N |
|
|
SO |
H |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
3 |
|
|
|
|
|
3 |
|
|
HO |
OH |
I |
π1-система |
HO |
OH |
II |
π2-система |
||||||||
|
|
|
|
||||||||||||
В дисазокрасителе (II) нафтилазо- и фенилазогруппы не сопряжены друг с другом, располагаясь в мета-положении друг к другу. В то же время каждая гидроксигруппа и фенильное кольцо находятся в сопряжении с каждым арилазофрагменом.
Следовательно, в центральном бензольном кольце дисазокрасителя перекрещиваются две сопряженные системы, содержащие по концам ЭД-заместители. В этих системах могут совершаться, по крайней мере, четыре различных по энергии электронных перехода с образованием возбужденных предельных структур (II a-г).
IIa
II б
N N |
N N |
- |
- |
N N |
N N |
HO |
+ |
|
II в |
HO |
+ |
OH |
|
|
OH |
||
N N |
N N |
- |
- |
N N |
N N |
+ |
OH |
|
II г |
+ |
OH |
HO |
|
|
HO |

Теория цветности органических соединений |
67 |
Вспектре поглощения красителя Кислотный светло-коричневый для кожи
(II)присутствуют несколько близко расположенных полос. Они перекрываются друг с другом и сливаются в одну широкую полосу в интервале 400-600 нм, характерную для соединения коричневого цвета (оранжево-красный с примесью серого цвета).
ε
a |
в |
б |
г |
 λ, нм
λ, нм
400 500 600
В азокрасителе на основе Гамма кислоты (III a) NH2-группа не сопряжена с фенилазогруппой, но взаимодействует с НО-группой, вследствие чего возникает перекрещивающаяся сопряженная система и краситель приобретает коричневый оттенок.
N N |
OH |
|
OH |
NH2 |
N N |
NHCOCH3 |
|
HO3S |
|
HO3S |
|
III а; Коричневато-оранжевый краситель |
III б; Ярко-оранжевый краситель |
||
Ацетилирование NH2-группы лишает её электронодонорных свойств, вторая система сопряженных связей перестает функционировать и краситель (III б) становится ярко-оранжевым.
В практике синтеза красителей создание перекрещивающихся сопряженных систем является обычным приемом получения красителей нечистых, смешанных цветов: коричневого, оливкового, черного.
Приведенные данные позволяют сформулировать
ности.
При введении в простые сопряженные системы ЭД-заместителей или присоединение к ним дополнительных сопряженных систем могут возникать конкурирующие разветвленные или перекрещивающиеся сопряженные системы.
В первом случае полоса поглощения смещается гипсохромно, и появляются новые, коротковолновые полосы, вследствие чего происходит повышение окраски или образование окраски, являющейся результатом сложения дополнительных цветов, если новая полоса находится в видимой части спектра.
Во втором случае происходит расширение полосы поглощения и образование окраски, отличающейся нечистым оттенком.
Лекция 10 4.6. Влияние пространственных факторов на поглощение света
При обсуждении светопоглощающих свойств сопряженных систем в предыдущих разделах предполагалось, что атомы в sp2-гибридном состоянии образующие сопряженную систему, лежат в одной плоскости. Только при таком условии оси pz-AO оказываются параллельными и орбитали находятся в наиболее благоприятном положении для перекрывания по π-типу (боковое перекрывание).

Теория цветности органических соединений |
68 |
Плоскостное строение сопряженной системы:
во-первых, обусловливает эффективное π-π и p-π взаимодействие между всеми участками цепи сопряжения и присоединенными к ней ЭД- и ЭА-заместителями;
во-вторых, обеспечивает максимальное сближение π-уровней основного и возбужденных состояний;
в-третьих, минимизирует потенциальную энергию всей π-системы.
Однако в реальных молекулах, которые имеют открытые участки сопряженной
цепи, как правило, проявляются силы противодействующие сопряжению. В результате
пространственного перекрывания между атомами и группами, которые присоединены
к сопряженной системе, в молекуле возникают пространственные напряжения.
|
|
+ |
|
Me2N |
H H |
NMe2 |
H3C CH3 |
|
C |
|
|
|
H H N H H |
Аурамин |
4,5-диметилфенантрен |
Поскольку молекулы всегда стремятся понизить внутреннюю энергию, напряжения могут сниматься или частично ослабляться любым из двух способов:
– поворотом или свободным вращением фрагмента молекулы относительно простой σ-связи, то есть нарушением копланарности;
– искажением нормальных валентных углов между связями, то есть без нарушения
плоскостности молекулы.
Рассмотрим, как пространственные эффекты влияют на положение и интенсивность характеристических полос поглощения сопряженных систем.
4.6.1. Нарушение копланарности сопряженной системы
Структурно близкий ряд соединений, представленных в таблице,: флуорен (1),
9,10-дигидрофенантрен (2), бифенил (3), 2-метилбифенил (4), 2,2'-диметилбифе-
нил (5) и бимезитил (6) имеют формально одинаковые 12 π-электронные системы. В то же время, эти молекулы отличаются в пространственном отношении, а именно, уг-
лом поворота (γ) бензольных колец относительно друг друга вокруг C-C биарильной
связи. Этот угол называется двугранным межплоскостным углом.
|
|
RH |
|
|
|
H |
|
R |
|
|
|
γ |
||
|
(1) |
H |
||
H |
(3-5) |
|||
|
|
Изменение величин межплоскостного угла в этом ряду соединений и положение полосы поглощения в спектре приведено в таблице и объясняется следующим образом.

|
Теория цветности органических соединений |
69 |
||||||||
|
Межплоскостной угол γ и положение К-полосы в электронных спектрах произ- |
|||||||||
|
водных бифенила. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
№ |
Соединение |
|
|
Формула |
|
|
γО |
|
Положение К-полосы |
|
|
|
|
|
|
|
|
|
|
λмакс , нм (ε) |
|
1 |
Флуорен |
|
|
CH2 |
|
|
0 |
|
267 (21000) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
9,10-Дигидрофенантрен |
|
|
H2C CH2 |
|
|
10 |
|
265 (17000) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H H |
|
|
|
|
|
|
3 |
Бифенил |
|
|
H H |
|
|
35 |
|
251 (15000) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2-Метилбифенил |
|
|
CH3 |
|
|
50 |
|
237 (12000) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
5 |
2,2'-Диметилбифенил |
|
|
CH3 |
|
|
70 |
|
218 (11000) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
Бимезитил |
|
|
H3C CH3 |
|
|
90 |
|
208 ( 9600) |
|
H3C |
|
H3C CH3 |
|
CH3 |
|
|
||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Связывание 2,2'-положений бифенила метиленовой группой фиксирует бензольные кольца в флуорене (1) в одной плоскости. Увеличение длины дополнительных связей между кольцами (2), разрыв жесткой связи между кольцами (3), увеличение числа объемистых СН3 -групп в положениях 2,2' (4→6) приводит к росту стерических напряжений, которые компенсируются увеличением межплоскостного угла от 0О
в плоском флуорене (1) до 90О в бимезитиле (6).
Переход в одно из возбужденных состояний этих молекул сопровождается однотипной поляризацией π-системы вдоль длинной оси и приближением молекулы к ди-
полярной ионной структуре, для которой характерно наличие двойной связи между кольцами.
|
E |
|
|
|
δE дополн |
hν |
|
|
|
|
|
+ |
: - |
|
|
|
|
R R |
R R |
|
|
|
ВЗМО |
|
|
|
|
|
|
|
1 |
2 |
3 |
4 |
5 |
Электронный переход такого типа аналогичен 1A→1La в бензоле и ему соответствует в спектре интенсивная K-полоса. В основном состоянии уровни энергии соединений (1-5) мало, чем отличаются друг от друга.

Теория цветности органических соединений |
70 |
Возникающие пространственные (стерические) напряжения в них снимаются поворотом вокруг существенно простой в основном состоянии биарильной связи.
Уровни энергии возбужденного состояния этих соединений должны заметно раз-
личаться. Поскольку поворот бензольных колец относительно двойной в возбужденном состоянии биарильной связи невозможен, перевод в возбужденное состояние не-
плоских молекул (2-5) потребует дополнительных затрат энергии для восстановления плоской структуры. Принято считать, что эта дополнительная энергия расходуется на деформацию σ-связей, которыми пространственно взаимодействующие группы присоединены к π-системе.
Чем больше межплоскостной угол в соединении по сравнению с плоским флуореном, тем большая энергия должна быть затрачена для возбуждения этой молекулы. Поэтому в ряду соединений (1-5) происходит увеличение энергии возбуждения, а в электронных спектрах наблюдается смещение K-полосы в коротковолновую область и понижение её интенсивности.
Приведенные примеры иллюстрирует стерический гипсохромный эффект.
В бимезитиле (6) пространственные трудности, создаваемые четырьмя орто- расположенными CH3-группами, настолько велики, что восстановление копланарности в возбужденном состоянии невозможно без разрыва биарильной связи.
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
CH3 H3C |
|
|
|
|
|
|
|
|
|
H3C |
|
|
|
hν |
H |
C |
+ |
|
:- -: |
+ |
CH |
|
|
|
H C |
|
|
CH |
|
|
3 Бимезитил, λ |
|
208 нм |
||||||||||
3 |
|
|
|
H C |
|
|
3 |
|
3 |
|
|
|
|
|
|
макс |
||
|
|
|
3 |
|
|
|
|
|
|
|
|
CH3 H3C |
|
|
|
|
||
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
При этом происходит полное разобщение бензольных π-систем и они взаимодействуют со светом независимо друг от друга, как две молекулы мезитилена.
H3C |
hν |
H3C |
|
|
|
||
|
|
CH3 |
-: |
+ |
CH3 |
Мезитилен, λмакс 206 нм |
|
|
|
|
|||||
|
|
|
|||||
|
|
|
|
||||
H3C |
|
H3C |
|
|
|
||
Поэтому положение K-полосы в спектрах бимезитила и мезитилена практически одинаково, а различие выражается лишь в большей интенсивности поглощения в случае бимезитила.
Это объяснение стерического гипсохромного эффекта сделано в рамках метода валентных связей. Оно не совсем корректно, так как противоречит принципу ФранкаКондона. За весьма малое время перехода молекулы в возбужденное состояние и существование в возбужденном состоянии (10-10 с) маловероятно значительное изменение геометрии молекулы, а тем более восстановление её копланарности.
Метод возмущения молекулярных орбиталей решает эту проблему строже и
корректно. Различия в энергиях π→π* электронных переходов, ответственных за появление и положение К-полосы в электронных спектрах соединений (1-5), (см. табл.) свидетельствуют о различиях в условиях формирования единой π-электронной системы этих производных бифенила.
Теория цветности органических соединений |
71 |
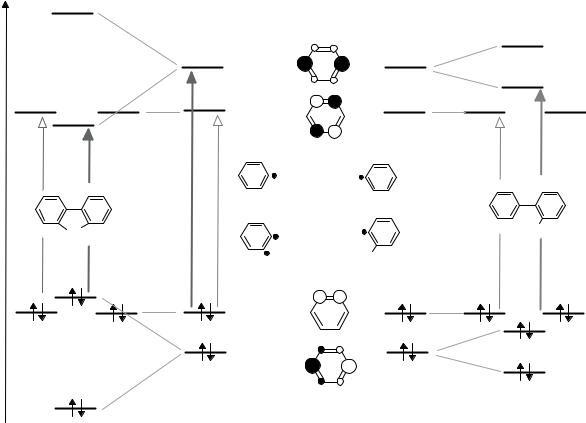
Для демонстрации общего подхода реконструируем итоговое взаимное расположение высшей занятой, нижней вакантной и второй вакантной молекулярной орбиталей для плоского флуорена (1) и не плоского 2-метилбифенила (4) путем анализа возмущений граничных π-МО двух радикальных фрагментов в процессе их рекомбинации с учетом реально существующего межплоскостного угла в этих молекулах.
В рассматриваемом примере двухцентрового возмущения не будет большой ошибкой предположить, что энергии π,π*-МО фенильного и орто-толильного радикалов или бирадикала орто-фенилена и бирадикала из толуола отличаются незначительно.
E
π |
*,(1L ) |
1 |
5 |
a |
2 |
|
|
π4*, (1Lb) 1
2 |
|
µ 1 |
|
2 |
CH2 |
µ |
К-полоса В-полоса
π3 1
2

1' ν
2'
CH3
ν |
H3C |
 CH2
CH2
π2 |
1 |
2 |
В результате первоначального связывания двух арильных фрагментов σ-связью становится возможным и изменения в энергии их π-электронных систем как следствие перекрывания и смешивания парных π3-, π4*-МО и π2-, π5*-МО соответствующих бирадикалов под влиянием возмущений первого порядка. Тогда величины изменения энергии орбиталей на величину δEπ соответствующую расщеплению R можно определить из выражений:
R = k Sµν ( Eµ + Eν ) = β ; δEπ = 2 ci cjβ ;
где ci и cj коэффициенты при АО молекулярных орбиталей арильных фрагментов для связываемых биарильной связью С-атомов 1 и 1'
Из первого уравнения следует, что расщепление R, а следовательно и сближение образующихся новых пар π и π*-МО в соответствующих биарилах, пропорционально

Теория цветности органических соединений |
72 |
интегралу перекрывания S, который призван учитывать степень взаимодействия (смешивания) π–систем µ и ν в месте их связывания.
R= f (β) = f (Sµν)
Всвою очередь величина интеграла перекрывания Sµν максимальна только при
условии параллельности осей симметрии π-облаков, что возможно при копланарном расположении биарильных фрагментов. Отклонение от копланарности приводит к
уменьшению Sµν пропорционально квадрату косинуса межплоскостного угла γ,
Sµν = So cos2γ ,
где cosγ меняется от 1 до 0, если γ возрастает от 0 до 90°.
Тогда в случае плоского флуорена (1) Sµν = So, то есть будет максимальным, поскольку cos20°=1. Для 2-метилбифенила (4), в котором межплоскостной угол равен 50°, Sµν будет составлять всего 0,4So (cos250° = 0,413). Таким образом, наибольшее расщепление взаимодействующих парных π3-, π4*-МО и π2-, π5*-МО следует ожидать в молекуле флуорена и заметно меньшее расщепление в молекуле 2-метилбифенила.
Однако, в соответствии со вторым уравнением, итоговое изменение энергий
±δEπ и взаимное расположение нового набора МО на энергетической шкале определяется также произведением собственных коэффициентов при АО для атомов, образующих биарильную связь.
Согласно данным квантово-химических расчетов (на диаграмме графически представлены величины собственных коэффициентов) только для пар π2-, π5*-МО ко-
эффициенты при всех АО составляющих эти МО, в том числе и для С1- и С′1-атомов отличны от нуля, что вызывает их результативное расщепление. Напротив, парные π3- , π4*-МО в результате связывания соответствующих арильных фрагментов войдут в систему π-уровней флуорена (1) и 2-метилбифенила (4) с неизменной энергией. Коэффициенты при АО для С1- и С′1-атомов, образующих биарильную связь, имеют нулевое значение и δEπ во втором уравнении обращается в ноль.
В результате в флуорене (1) происходит наибольшей сближение граничных орбиталей, причем низшей вакантной орбиталью оказывается МО, произведенная из π5*- орбитали 1La –типа (см. диаграмму и рис.). Возбуждение электрона с ВЗМО на эту орбиталь соответствует поляризации молекулы вдоль длинной оси и порождает К- (1La-) полосу самую длинноволновую полосу в спектре флуорена, которая перекрывает В- полосу.
y |
− |
|
|
|
|
|
|
|
.. |
|
hν2 |
|
|
hν1 |
|
:− |
|
|
x |
|
|
|
+ |
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
+ CH |
2 |
B - полоса |
CH |
2 |
К - полоса |
|
CH |
|
|
|
|
|
|
2 |
В неплоском 2-метилбифениле (4) из-за меньшего расщепления π2-, π5*-МО орбитали 1La –типа становится второй вакантной МО, электронный переход на неё потребует большей энергии и К-полоса сместится гипсохромно по сравнению с её положением в электронном спектре флуорена (см. рис.). В этом случае низшей вакантной орбиталью оказывается, МО произведенная из π4*-орбитали 1Lb-типа. Теперь электронный переход между граничными орбиталями соответствует поляризации мо-

Теория цветности органических соединений |
73 |
лекулы вдоль короткой оси, а порождаемая таким электронным переходом В- (1Lb-)- полоса проявляется как самая длинноволновая в виде частично перекрытых максимумов на правом склоне, гипсохромно смещенной К-полосы.
ε |
|
|
|
|
50000 |
К-полоса |
Электронные спектры поглощения: |
||
|
|
|
1- флуорена (1); |
|
10000 |
|
|
|
|
3 |
|
2 |
1 |
CH2 |
|
|
|||
5000 |
|
|
2- 2-метилбифенила (4); |
|
1000 |
|
|
|
CH3 |
|
|
|
3- бимезитила (6). |
|
500 |
|
|
|
H3C CH3 |
|
|
H3C |
CH3 |
|
|
|
В-полоса |
||
100 |
|
|
λ, нм |
H3C CH3 |
240 |
260 |
280 |
|
|
220 |
|
|||
В случае бимезитила с ортогональным расположением фенильных ядер, эффективное π,π-взаимодействие между ними невозможно, поскольку величина интеграла перекрывания Sµν обращается в ноль (cos290° = 0). Поэтому в систему электронных уровней бимезитила π,π*-МО фрагментов мезитила в виде двух наборов вырожденных орбиталей. В электронном спектре бимезитила (см. рис.) максимумы поглощения К- и В-полосы располагаются практически при тех же длинах волн, что и в спектре мезитилена, но с примерно вдвое большей интенсивностью.
Аналогичная процедура сравнительной реконструкции π-орбитальной структуры позволяет объяснить обстоятельства ослабления электронного влияния поляризующих ЭД- и ЭА-заместителей на связанные с ними сопряженные системы под влиянием пространственных затруднений, то есть ингибирование p,π- π,π-взаимодей- ствия в сложных сопряженных системах.
Изменение геометрии (конфигурации) сопряженной системы путем нарушения
копланарности ее частей широко применяется в практике получения красителей различных цветов и различных технических классов.
Например, на основе п-диметиламино-п'-нитроазобензола получена серия пигментов, цвет которых постепенно повышается от красновато-оранжевого до желтого.
|
|
|
|
|
|
CH3 |
|
|
|
CH3 |
|
|
|
|
..CH3 |
|
|
|
|
|
HC CH3 |
|
|||
O2N |
N N |
O2N |
N N |
.. |
CH3 |
O2N |
N N |
.. |
CH |
|
||
N |
|
N |
|
N |
|
3 |
||||||
|
|
CH |
3 |
|
|
|
CH3 |
|
|
|
CH3 |
|
|
λмакс 473 нм (ε) |
|
|
λмакс 440 нм (0,75 ε) |
|
λмакс 420 нм (0,60 ε) |
|
|||||
Это достигается введением в о-положение к (CH3)2N-группе объемистых замес-

Теория цветности органических соединений |
74 |
тителей. При увеличении размера заместителя (переход к Me-, а затем к изо-Pr) возрастающие пространственные трудности выводят диметиламиногруппу из плоскости кольца. Вследствие этого ослабевает р-π взаимодействие неподеленной пары электронов азота с π-системой азобензола. Ослабление ЭД-эффекта (CH3)2N-группы сопро-
вождается гипсохромным сдвигом максимума поглощения
сивности полосы поглощения.
Следующий пример показывает, что нарушение копланарности молекулы красителя может вызвать не только повышение цвета, но и существенно ослабить силы
сродства красителя к целлюлозному волокну (межмолекулярное взаимодействие мо-
лекул красителя и волокна, закрепляющее краситель на волокне).
|
|
OH |
HO |
|
|
|
OH |
SO3H |
HO |
|
|
|
|
N N |
N N |
|
|
|
N N |
|
N N |
|
|
|
|
|
SO2 |
|
|
|
|
HO3S |
|
|
|
HO |
S |
Прямой фиолетово-красный |
SO |
H |
HO3S |
Кислотный оранжевый К |
SO |
H |
|||
3 |
|
3 |
|
|
3 |
|
|||||
В результате разрыва жесткой SO2-связи между бензольными кольцами и введение в о,о'-положения бифенила двух объемистых сульфогрупп в оранжевом красителе моноазофрагменты располагаются под углом примерно 60о между плоскостями.
Неплоская молекула лишается способности прочно взаимодействовать с целлюлозным волокном, оранжевый краситель на основе бензидин-2,2’-дисульфокислоты утрачивает субстантивность и оказывается не прямым, а кислотным красителем.
Иногда ослабление пространственного взаимодействия объемных заместителей недостаточно, чтобы вызвать углубление цвета соединения, однако частичное снятие стерических препятствий сопряжению вызывает рост интенсивности поглощения.
CH3 |
H3C |
N |
|
|
H |
N N |
OH |
N |
N N |
|
|
C |
|||
N N |
N Ph |
HO |
N N |
C |
|
|
|
Ph N |
|
SO3Na |
COOH |
||||
OH |
NaO3S SO3Na HO |
|
|
|
H |
||
|
|
|
|
COOH |
NaO3S |
|
|
Кислотный желтый К |
|
|
Прямой оранжевый светопрочный У |
||||
Сопоставление строения красителей Кислотный желтый К и Прямой оранжевый светопрочный У показывает, что во втором красителе за счет внедрения между бензольными кольцами виниленовой группы расстояние между объемными сульфогруппами увеличивается и пространственные затруднения в молекуле понижаются. Поэтому краситель на основе стильбен-2,2’-дисульфокислоты становится более ярким, приобретает сродство к целлюлозному волокну, что свидетельствует о частичном восстановлении плоскостности его молекулы.
Разобщение отдельных частей сопряженной системы вследствие свободного вращения вокруг простой связи используется для получения эффекта внутримолекулярного смешения цветов. Например, зеленый цвет трис-азокрасителя соответствует смеси желтого моноазокрасителя и темно-синего дис-азокрасителя.
