
- •Введение
- •1. Физические основы цветности
- •1.1. Природа света и происхождение цветоощущения
- •Спектральный цвет
- •Дополнительный цвет
- •1.3. Взаимодействие электромагнитного излучения с веществом
- •1.3.1. Конфигурация электронно-колебательных уровней
- •1.3.2. Принцип Франка-Кондона и форма полос поглощения
- •2. Анализ электронной структуры методами квантовой химии.
- •2.1. Способы описания энергетических состояний молекул.
- •2.3. Формирование МО и основные типы электронных переходов
- •3. Экспериментальные методы изучения электронной структуры
- •3.1. Фотоэлектронная спектроскопия
- •3.2. Электронная трансмиссионная спектроскопия
- •4. Основные положения теории цветности
- •4.1.2. Энергии электронных переходов в сопряженных системах
- •4.2.1. Переходы в гетероцепных четных альтернантных системах
- •4.3.1. Классификация заместителей
- •4.3.2. Электронодонорные заместители
- •4.3.3. Электроноакцепторные заместители
- •4.3.4. Совместное действие поляризующих ЭД и ЭА заместителей
- •4.3.5. Полосы переноса заряда
- •4.4. Влияние ионизации на поляризующее действие заместителей
- •4.4.1. Ионизация ЭД-заместителей
- •4.4.2. Ионизация ЭА-заместителей
- •4.4.3. Ионизация сложных молекул
- •4.5.1. Разветвленные сопряженные системы
- •4.5.3. Перекрещивающиеся сопряженные системы
- •4.6. Влияние пространственных факторов на поглощение света
- •4.6.1. Нарушение копланарности сопряженной системы
- •4.6.2. Искажение валентных углов
- •4.7. Комплексообразование с металлами
- •4.7.1. Комплексообразование с углублением цвета
- •4.7.2. Комплексообразование без углубления цвета
- •5. Хромофорная система красителей

Теория цветности органических соединений |
59 |
Превращение аминогруппы в аммониевую группу существенно меняет характер влияния заместителя на соседнюю сопряженную систему. Вследствие исчезновения неподеленной пары электронов, аммониевая группа утрачивает свойства ЭД-замести- теля. Она взаимодействует с π-системой только как сильный индуктивный (-I) заместитель, повышая электроотрицательность связанного с ним атома.
Таким образом, при ионизации NH2-группы фактически происходит укорочение π-системы и молекула взаимодействует со светом, как будто этого заместителя нет. Например, при протонировании анилина его К- и В-полосы в спектре претерпевают гипсохромный сдвиг.
Соединения |
Положение полосы в ЭС λмакс , нм (ε) |
||
К-полоса |
В-полоса |
||
|
|||
Анилин |
230 (8600) |
280 (1430) |
|
Анилиний гидрохлорид |
203 (7500) |
254 ( 160) |
|
Бензол |
203 (7400) |
255 ( 304) |
|
В результате спектральная кривая анилиний-катиона практически не отличается от кривой незамещенного бензола.
4.4.2. Ионизация ЭА-заместителей
Среди электроноакцепторных заместителей, только карбонильная и хинониминная группы протонируются в водных растворах кислот. Присоединение протона происходит к атому кислорода или азота за счет имеющихся у них неподеленных пар электронов, расположенных на несвязывающих АО spили sp2-типа.
C |
О: + |
H+ |
+ |
C NH + |
H+ |
+ |
|
C ОН |
C NH |
2 |
|||||
|
.. |
|
.. |
.. |
|
|
Протонирование сопровождается появлением положительного заряда на атомах азота или кислорода. Так как ионизация не затрагивает π-связь, увеличение электроотрицательности гетероатома усиливает внутреннюю поляризацию в самом заместителе. Поэтому электроноакцепторное действие протонированных карбонильной и хинониминной групп на соседнюю сопряженную систему усиливается.
Это в свою очередь вызывает батохромный и гиперхромный сдвиг полос поглощения сопряженной системы.
.. |
NH |
.. |
+ |
H2N |
H2N |
NH2 |
|
|
H+ |
|
|
|
4-аминофуксонимин, желтый |
|
Фиолетовый Дейбнера |
Действительно обработка 4-аминофуксонимина, соединения желтого цвета, водной соляной кислотой приводит к образованию интенсивно окрашенного красителя -
Фиолетового Дейбнера.

Теория цветности органических соединений |
60 |
4.4.3.Ионизация сложных молекул
Всложных сопряженных системах красителей, содержащих ионизирующиеся ЭД- и ЭА-заместители, ионизация может происходить ступенчато, поэтому возможности изменения окраски красителя в зависимости от рН среды увеличиваются.
Это обстоятельство позволяет использовать такого рода красители в качестве кислотно-основных индикаторов.
Например, Феноловый красный (Бензауринсульфокислота) существует в неионизированной форме как вещество желтого цвета в интервале рН 3-8.
.. |
O |
|
HO |
O |
HO |
+ |
:O |
|
OH |
||||
.. |
|
HO |
|
|
H+ |
|
|
|
|
|
|
||
|
SO3Na |
pH > 8 |
|
SO3Na |
pH < 3 |
SO3Na |
558 нм (пурпурный) |
|
|
433 нм (желтый) |
|
503 нм (красный) |
|
Его цвет углубляется в кислой среде до красного, вследствие протонирования карбонильной группы, и в щелочной среде – до пурпурного, за счет протолиза гидроксигруппы. При ионизации εмакс полосы в видимой области возрастает в 2,2 и 2,7 раза, соответственно.
Изложенный материал позволяет сформулировать четвертое положение теории
цветности.
Ионизация, приводящая к усилению электронодонорности ЭД-заместите- лей или электроноакцепторности ЭА-заместителей, сопровождается сдвигом полос поглощения в длинноволновую область и росту их интенсивности.
Если ионизация уничтожает электронодонорность ЭД-заместителя, происходит смещение полос в коротковолновую область.
4.5. Сложные конкурирующие и перекрещивающиеся сопряженные системы
Лекция 9 |
|
|
|
Сопряженные системы одним ЭД- и одним ЭА-заместителем по концам, напри- |
|||||
|
мер, 1-амино-4-ацетилбутадиен, являются простейшими. Присоединение к цепочке |
||||||||
|
|
|
Y |
|
|
CH3 |
сопряженных двойных связей между концевыми ЭД- и ЭАзамес- |
||
|
|
y |
|
|
тителями дополнительной π-системы или дополнительных поля- |
||||
H2N |
y |
y |
y |
C |
O |
ризующих заместителей усложняет сопряженную систему и вызы- |
|||
вает изменения в поглощении света. Характер возникающих при этом спектральных эффектов определяется топологией сложной сопряженной системы.
4.5.1. Разветвленные сопряженные системы
Разветвленные сопряженные системы возникают, когда новые заместители или
дополнительные π-системы вступают в сопряжение с заместителями, имеющимися в простой сопряженной системе.
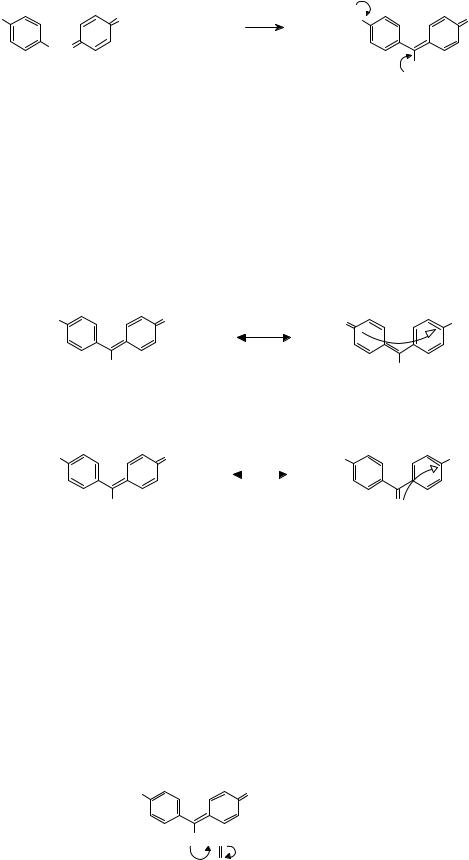
Например, такая ситуация реализуется, когда к мостиковому атому в молекуле гидрола Михлера присоединяется электронодонорная аминогруппа, в результате чего образуется молекула Аурамина.
|
|
Теория цветности органических соединений |
61 |
|
.. |
|
+ |
.. |
+ |
Me2N |
|
NMe2 |
Me2N |
NMe2 |
|
CH |
Гидрол Михлера |
|
Аурамин |
|
|
|
|
|
:NH2
В молекуле Аурамина можно выделить две цепочки сопряженных двойных свя-
зей:
–одну пятизвенную с Me2N-группой и ионизированной хинониониминной группой по концам, принадлежавшей системе гидрола Михлера;
–другую новую, трехзвенную с H2N-группой и хинониминной группой по концам.
Поскольку обе цепочки имеют общий участок, можно говорить о возникновении разветвленной сопряженной системы с разветвлением у центрального атома. При фотовозбуждении в Аурамине совершаются следующие электронные переходы:
в первоначальной, пятизвенной сопряженной системе, характерной для гидрола Михлера, который обусловливает появление полосы с λмакс при 430 нм;
.. |
|
+ |
|
+ |
.. |
Me2N |
|
NMe2 |
hν |
Me2N |
NMe2 |
: |
|
|
λмакс 430 нм |
|
: |
NH |
2 |
|
|
|
|
|
|
|
|
NH2 |
и в новой, более |
короткой, трехзвенной сопряженной системе, который обуслов- |
||||
ливает появление новой полосы в УФ-части спектра с λмакс при 372 нм. |
|||||
.. |
+ |
|
|
.. |
.. |
Me2N |
NMe2 |
|
hν |
Me2N |
NMe2 |
|
:NH2 |
λмакс 372 нм |
+NH2 |
||
Наблюдаемое повышение цвета от синего в гидроле Михлера (λмакс 603 нм) до желтого в Аурамине объясняется уменьшением постоянного смещения π-электронов в пятизвенной цепочке на участке между концевой Me2N-группой и новым ЭД-замес- тителем, которое
телями с ЭА-группой.
Таким образом, появление конкурирующих сопряженных систем равносильно
укорочению цепи сопряжения и сопровождается гипсохромным сдвигом полосы поглощения.
Ацетилирование H2N-группы в Аурамине резко уменьшает электронодонорный эффект этого заместителя. Поэтому в Ацетилаурамине цепь сопряжения восстанавливается почти до такого же состояния, как у гидрола Михлера, и окраска производного вновь углубляется до синей.
.. |
+ |
|
Me2N |
NMe2 |
|
|
|
Ацетилаурамин (синий) |
|
:NH-C-CH3 |
λмакс 590 нм |
|
O |
|
Разветвленные конкурирующие системы возникают и при замыкании бензоль-

Теория цветности органических соединений |
62 |
ных колец молекулы гидрола Михлера гетероатомными мостиками (-NH-, -O-, -S-). В образующихся трехъядерных, плоских гетероциклах неподеленная пара электронов гетероатома располагается на pZ-AO, имеющей π-симметрию. Поэтому мостиковый
гетероатом обладает свойствами ЭД-заместителя.
+ |
.. |
.. |
|
+ |
Me N |
X |
NMe |
|
Me2N |
X |
NMe2 λ1максMe2N |
X |
|
||||
NMe2 λ2макс |
2 |
+ |
2 |
|||||
.. .. ..
X = NH , O , ..S
..
Разветвленная сопряженная система этих гетероциклов однотипна и состоит из:
одной, пятизвенной цепочки, характерной для гидрола Михлера, располо-
женной между электронодонорной Mе2N-группой и электроноакцепторной хинониминной группой;
другой, двухзвенной цепочки между электронодонорным гетероатомом X: и
хинониминной группой.
Вследствие конкуренции между Ме2N-группой и гетероатомом в сопряжении с ЭА-заместителем электронный переход в пятизвенной цепочке потребует большей энергии, чем в гидроле Михлера. Поэтому соответствующая этому переходу длинноволновая полоса в спектрах гетероциклических красителей будет
по сравнению с ее первоначальным положением в спектре гидрола
Михлера.
Электронный переход в двухзвенной цепочке обусловливает появление в спек-
тре красителей второй, более коротковолновой полосы.
.. |
.. |
+ |
|
1 |
2 |
Me2N |
X |
NMe2 |
-X- |
||
|
|
|
λ макс , нм |
λ макс , нм |
|
|
|
|
|
|
|
Гидрол Михлера |
|
нет |
603 |
нет |
|
Акридиновый оранжевый |
NH |
488 |
305 |
||
Пиронин (красный) |
|
O |
550 |
510 |
|
Метиленовый красный |
S |
568 |
505 |
||
Из данных приведенных в таблице видно, что величина гипсохромного сдвига
длинноволновой полосы определяется электронодонорностью гетеромостика..
NH-группа наиболее сильный ЭД-заместитель в этом ряду, поэтому в Акридиновом оранжевом имеет место наибольшая конкуренция и наблюдается наибольшее повышение окраски.
Кислород, как более электроотрицательный атом, сильнее удерживает свою неподеленную пару и является более слабой электронодонорной мостиковой группой, чем азот. Поэтому цвет Пиронина повышается только до красного.
Сера - элемент 3-его периода. В нем неподеленная пара электронов π-симметрии расположена на 3pZ-AO - орбитали большего размера. Вследствие худших условий 3рπ -2рπ перекрывания с π-системой электронодонорность сульфидного мостика оказывается наименьшей. Цвет Метиленового красного (Тиопиронина) имеет заметный фиолетовый оттенок.
Противоположный спектральный эффект наблюдается в случае присоединения
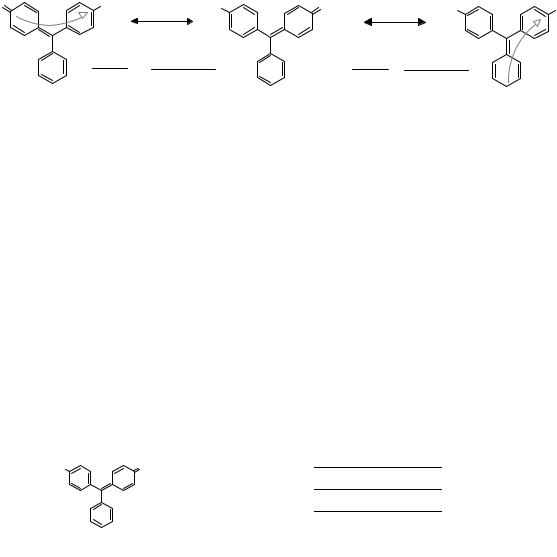
Теория цветности органических соединений |
63 |
к центральному атому углерода гидрола Михлера бензольного кольца.
Обогащение простой сопряженной системы между ЭД- и ЭА-заместителями π-электронами приводит к батохромному сдвигу полосы поглощения, порожденной электронным переходом в исходной пятизвенной сопряженной цепочке, λ1макс .
+ |
.. |
.. |
+ |
.. |
.. |
Me2N |
NMe2 |
Me2N |
NMe2 |
Me2N |
NMe2 |
|
λ1макс |
621 нм |
λ2макс |
430 нм |
|
|
ε1 |
51300 |
ε2 |
13200 |
+ |
|
|
Малахитовый зеленый |
|
||
|
|
|
|
||
Одновременно в Малахитовом зеленом возникает новая разветвленная цепоч-
ка сопряжения, которая включает бензольное и хиноидно построенное ядро с ЭА-за- местителем. Из-за отсутствия во второй конкурирующей системе поляризующего заместителя электронный переход в ней менее вероятен и требует большей энергии. Соответствующая этому переходу полоса располагается в коротковолновой области и имеет меньшую интенсивность.
Таким образом, в результате разветвления сопряженной системы в видимой части спектра Малахитового зеленого появляются две полосы с λмакс 621 нм и 430 нм. Первая полоса обусловливает дополнительный голубой цвет, вторая - желтый. В результате внутримолекулярного смешения цветов образуется краситель зеленого цвета.
Введение в п"-положение третьего бензольного кольца молекулы Малахитового зеленого CH3О-группы - ЭД-заместителя средней силы, облегчает электронный переход во второй, конкурирующей сопряженной системе. Благодаря этому, вторая по-
смещается батохромно и ее интенсивность возрастает.
Положение полос поглощения в ЭС Малахитового зеленого и его п"-производных
Me2N |
+ |
R |
λ1макс , нм (ε) |
λ2макс , нм (ε) |
||
|
NMe2 |
|
|
|
||
H |
621 (51300) |
430 (13200) |
||||
|
|
|
||||
|
|
|
OCH3 |
600 (95000) |
477 (33100) |
|
|
|
|
NMe2 |
590 (100000) |
||
|
|
|
||||
|
R |
+NHMe2 |
630 ( ? ) |
436 ( ? ) |
||
Одновременно, вследствие конкуренции в сопряжении между Me2N- и CH3O-
группами с ЭА-заместителем, затрудняется смещение π-электронов в исходной, пяти-
звенной системе. Поэтому первая полоса претерпевает гипсохромный сдвиг. Ситу-
ация, подобная той, что наблюдается в красителях - гетероциклических производных гидрола Михлера.
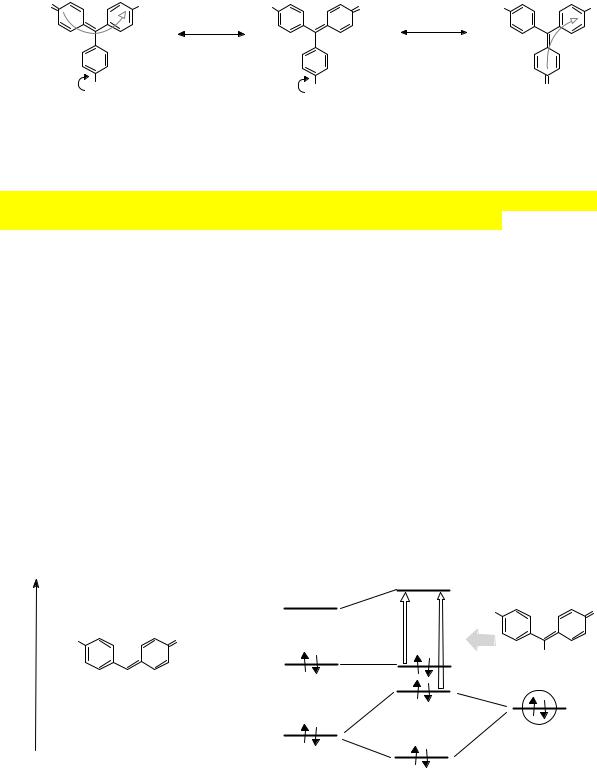
Усиление электронодонорности второго заместителя увеличивает встречное смещение полос. Так при введении в п"-положение третьего бензольного кольца Me2N-группы (Кристаллический фиолетовый) по концам конкурирующих сопряженных систем располагаются два одинаковых и более сильных ЭД-заместителя и
обе полосы сливаются в одну интенсивную полосу (результат батохромного сдвига
коротковолновой полосы и гипсохромного сдвига длинноволновой полосы).
|
Теория цветности органических соединений |
|
|
|
64 |
|||||||
+ |
.. |
|
Me |
.. |
|
+ |
|
|
Me |
.. |
.. |
|
Me2N |
NMe2 |
λ1 |
N |
|
NMe |
2 |
λ2 |
N |
NMe |
2 |
||
|
|
2 |
|
|
|
2 |
|
|
||||
|
|
|
макс |
|
|
|
|
макс |
|
|
|
|
|
гипсохромный сдвиг |
|
батохромный сдвиг |
|
|
|||||||
|
:R |
|
|
|
:R |
|
|
|
|
+ |
R + |
|
|
|
|
|
|
|
R = H, OCH3, NMe2, HNMe2 |
|
|
||||
Однако стоит уничтожить электронодонорность второй Me2N-группы путем её протонирования до Me2HN+-группы, как восстанавливается первоначальная цепь сопряжения. При рН 2 раствор Кристаллического фиолетового становится зеленым.
4.5.2. Объяснение спектральных закономерностей при образовании разветвленных сопряженных систем методом возмущения МО
Закономерности сдвига полос при образовании разветвленных сопряженных систем находят более простое и убедительное объяснение в рамках метода возмущения МО.
Сопряженные системы, которые содержат один ЭД-заместитель, в том числе Гидрол Михлера и Малахитовый зеленый, должным быть отнесены к нечетным
альтернантным системам (НЧАС).
Рассмотренные выше примеры их усложнения, приводящие к разветвленным сопряженным системам, есть ни что иное, как двухцентровое или трехцентровое возмущение нечетной альтернантной системы.
Имея это в виду, оценим характер изменений в расположении граничных МО
красителей в результате присоединения к непомеченному атому ЭД-заместителя –
случаи перехода от гидрола Михлера к Аурамину, гетероциклическим красителям типа Пиронина или от Малахитового зеленого к его пара"-замещенным.
Для того, чтобы не перегружать диаграмму орбитальных энергий, нанесем на неё только три, наиболее сближенные орбитали НЧАС (субстрата) и π-орбиталь ЭД-заместителя, заселенную неподеленной парой электронов.
E
|
|
|
|
|
|
|
НВМО |
.. |
+ |
|
|
|
|
|
|
|
Me2N |
NMe2 |
|
*.. |
|
|
|
|
|
|
λ1 |
||
|
|
|
* o |
+ * |
λ2 |
|
|||
Me N o * |
o |
o |
NMe |
2 |
|
|
|||
2 |
|
|
|
|
|
NH2 |
|||
* |
* |
o |
|
* |
* |
|
НСВ МО |
|
|
o |
. |
|
o |
|
(ВЗМО) |
|
|
||
|
.. |
|
|
|
2-ЗМО |
. NH |
2 |
||
|
|
|||
pZ |
-AO |
|||
|
||||
Перекрывание различающихся по энергии n-AO нового ЭД-заместителя и π,π*-МО исходной сопряженной системы должно привести к изменению энергии этих орбиталей на величину δEπ (R -расщепление), которое оценивают по уравнению вида.

Теория цветности органических соединений |
65 |
|||||
R = 2c i |
c |
ЭД |
β 2 |
В случае одноорбитальной |
|
|
Eψ0- E n-AO |
π-системы ЭД-заместителя |
сj =1 |
||||
0 |
|
|||||
|
|
|
|
|
||
При этом энергия ВЗМО, которая является НСВ МО, не изменится, так как замещение происходит у непомеченного атома (iо), а его АО входит в НСВ МО с нулевым коэффициентом.
Впарных π- и π*-МО этот коэффициент не равен нулю. Поэтому НВМО повысит свою энергию. Расщепление сближенных 2-ЗМО и n-МО будет гораздо большим, причем вклад неподеленной пары ЭД-заместителя в формировании новой пары связывающих МО окажется значительным.
Витоге энергетическая щель между ВЗМО и НВМО разветвленной системы
увеличится, энергия длинноволнового π→π* электронного перехода возрастет и со-
ответствующая полоса поглощения сместится гипсохромно.
Кроме того, в замещенной молекуле возможен и больший по энергии электрон-
ный переход между сближенными 2-ЗМО и НВМО, который теория валентных связей объясняет смещением π-электронов в конкурирующей и более короткой сопряженной цепочке.
Действительно в Аурамине, Пиронине, п"-метокси-Малахитовом зеленом мы наблюдали повышение окраски и появление дополнительной, коротковолновой полосы в спектрах этих красителей. Понятно, что относительное положение граничных МО в этих соединениях другое и будет определяться энергией МО в исходных системах и параметрами их возмущения.
Второй случай – образование сопряженной системы Малахитового зеленого можно рассматривать как результат возмущения π-МО гидрола Михлера при подключении к нему сложного М-заместителя - бензольного ядра.
При связывании радикалов молекулы гидрола Михлера и бензола через непомеченный атом (на корреляционной диаграмме для простоты приведены только граничные орбитали субстрата и заместителя) будет происходить попарно взаимодействие π,π*-орбиталей.
E |
|
|
|
Малахитовый зеленый |
|
|
|
|
|
|
|
π4* |
|
|
|
|
|
НВМО |
|
|
|
|
|
|
|
|
|
Me |
.. |
+ |
|
λ1макс |
λ2макс |
. |
N |
NMe |
|
||||
2 |
|
|
2 |
НСВ МО |
|
|
|
|
. |
|
(ВЗМО) |
|
|
|
|
|
|
|
|
|
|
|
|
|
2-ЗМО |
|
π3 |
Однако ВЗМО, которая является НСВ МО, не изменит своей энергии, так как АО центрального атома входит в нее с нулевым коэффициентом.
