
- •80 Теория цветности органических соединений
- •Часть 1 Теория цветности органических соединений
- •1. Физические основы цветности
- •1.1. Природа света и происхождение цветоощущения
- •1.2. Спектральный способ регистрации поглощенного света и спектральная терминология
- •1.3. Взаимодействие электромагнитного излучения с веществом
- •1.3.1. Конфигурация электронно-колебательных уровней
- •1 Лекция 3.3.2. Принцип Франка-Кондона и форма полос поглощения
- •2. Анализ электронной структуры методами квантовой химии.
- •2.1. Способы описания энергетических состояний молекул.
- •2.2. Основные принципы метода возмущения молекулярных орбиталей
- •2.3. Формирование мо и основные типы электронных переходов
- •3. Экспериментальные методы изучения электронной структуры
- •3.1. Фотоэлектронная спектроскопия
- •3.2. Электронная трансмиссионная спектроскопия
- •4. Основные положения теории цветности
- •4.1. Электронные переходы в молекулах углеводородов
- •4.1.1. Энергии электронных переходов в насыщенных углеводородах
- •4.1.2. Энергии электронных переходов в сопряженных системах
- •4.1.3. Энергия электронных переходов в ароматических углеводородах
- •4.1.4. Альтернантные и неальтернантные -системы
- •4.1.5. Типы возмущений и их влияние на энергию –мо
- •4.2. Электронные переходы в молекулах, содержащих гетероатомы
- •4.2.1. Переходы в гетероцепных четных альтернантных системах
- •4.2.2. Переходы в гетероцепных нечетных альтернантных системах
- •4.3. Влияние поляризующих заместителей на поглощение света сопряженными системами
- •4.3.1. Классификация заместителей
- •4.3.2. Электронодонорные заместители
- •4.3.3. Электроноакцепторные заместители
- •4.3.4. Совместное действие поляризующих эд и эа заместителей
- •4.3.5. Полосы переноса заряда
- •4.4. Влияние ионизации на поляризующее действие заместителей
- •4.4.1. Ионизация эд-заместителей
- •4.4.2. Ионизация эа-заместителей
- •4.4.3. Ионизация сложных молекул
- •4 Лекция 9.5. Сложные конкурирующие и перекрещивающиеся сопряженные системы
- •4.5.1. Разветвленные сопряженные системы
- •4.5.2. Объяснение спектральных закономерностей при образовании разветвленных сопряженных систем методом возмущения мо
- •4.5.3. Перекрещивающиеся сопряженные системы
- •4 Лекция 10.6. Влияние пространственных факторов на поглощение света
- •4.6.1. Нарушение копланарности сопряженной системы
- •4.6.2. Искажение валентных углов
- •4.7. Комплексообразование с металлами
- •4.7.1. Комплексообразование с углублением цвета
- •4.7.2. Комплексообразование без углубления цвета
- •5. Хромофорная система красителей
2.2. Основные принципы метода возмущения молекулярных орбиталей
В
Лекция
4
Ковалентная связь возникает в направлении максимального перекрывания базисных орбиталей. Реализация этого принципа в значительной мере определяет:
геометрию образующейся молекулы;
энергетическую стабилизацию молекулярной системы, поскольку на энергетической оси связывающая МО располагается ниже базисных орбиталей.
Поэтому результат взаимодействия орбиталей зависит от формы,размераэлектронных облаков и ихвзаимной ориентациив пространстве.
Возможны два типа перекрывания, в которых принимают участие орбитали, имеющиер-характер (p-, sp-, sp2-, sp3-орбитали).
-перекрывание или фронтальное перекрываниепроисходит,когда оси симметрии орбиталей лежат на одной прямой. Этому условию отвечает и перекрывание со сферическими s-орбиталями, например, при возникновении C-H связей. Такой тип взаимодействия мало зависит от взаиморасположения других осей координат взаимодействующих атомов или молекулярных фрагментов. В данном случаеинтеграл перекрыванияSвсегда больше нуля. Его значение меняется от 0,85 до 0,6 и зависит от гибридного состояния атома и отчасти, к какому периоду принадлежит атом.

-перекрывание или боковое перекрываниевозможно,когда оси взаимодействующих орбиталей параллельны.Наилучшим образом этому условию могут удовлетворятьрz-АО иМО,тогда величинаинтеграла перекрыванияSбольше нуля.

Очень важно, что Sможет меняться в диапазоне 0,2 – 0,0, что сильно зависит от геометрического фактора. Эффективнее всего перекрываются электронные облака атомов одного периода. Нарушение параллельности осей симметрии электронных облаков также снижает величину интеграла перекрывания и приортогональном расположении облаковотносительно линии связи перекрывание по-типу становится невозможным. Вместе с тем, даже при наиболее благоприятных условиях перекрывания значение интегралов перекрыванияS, всегда меньше чемS.(S <S ).
Согласно теории возмущения молекулярных орбиталей Дьюара, формирование новых МО рассматривается как возмущение взаимодействующих атомных или молекулярных орбиталей.(М. Дьюар, Р. Догерти. Теория возмущений молекулярных орбиталей в органической химии, Мир, 1977 г).
На диаграмме орбитальных энергий процесс формирования МО изображается следующим образом:

Возмущение выглядит так, как будто взаимодействующие орбитали и отталкиваются, сдвигаясь в противоположные стороны относительно своего первоначального положения на величину R , которую называют расщеплением.
Расщепление между вырожденными орбиталями, то есть орбиталями с одинаковой энергией, называют возмущением первого порядка. Например, такая ситуация возникает при образовании этана в результате взаимодействия двух метильных радикалов при перекрывании их sp3-орбиталей, несущих по неспаренному электрону.
Возмущение первого порядка всегда приводит к максимальному расщеплению. В этом случае расщепление R равно резонансному интегралу, а величину расщепления вычисляют по уравнению:
-

где
S - интеграл перекрывания взаимодействующих орбиталей и ;
E, E - энергии взаимодействующих орбиталей.
Расщепление между орбиталями различной энергии (это наиболее частый случай) называют возмущением второго порядка. При этом энергетически более низкая орбиталь смешивается связывающе с более высокой и уменьшает энергию (стабилизируется). Напротив, энергетически более высокая орбиталь смешивается разрыхляюще и увеличивает энергию (дестабилизируется).

Например, такая ситуация возникает при образовании молекулы этиламина в результате взаимодействия двух радикальных частиц, в которых углерод находится в состоянии sp3-гибридизации, а азот в состоянии sp3- илиsp2- гибридизации.
Возмущение второго порядка приводитк меньшему расщеплениюR, поскольку величина расщепления обратно пропорциональна разности энергии взаимодействующих орбиталейЕ. В случае возмущения второго порядка величину расщепленияRвычисляют по уравнению:
![]()
В результате из однократно занятых орбиталей образуетсяновая парамолекулярных орбиталей. Меньшая по энергии заполняется парой электронов, осуществляющих ковалентную связь, и становитсясвязывающей. Парная ей с большей энергией остается незаселенной,вакантнойи становитсяразрыхляющей.
Энергетическая щель - разность между связывающей и разрыхляющей орбиталями свидетельствует о выигрыше энергии при образовании данной связи.
Перекрывание и смешивание дважды занятых орбиталей также возможно и приводит к стабилизации системы, если хотя бы одной орбитали соответствует парная разрыхляющая орбиталь той же симметрии, то есть она является молекулярной или фрагментной.
Примером может служить формирование системы -МО в этиленамине.Представим, что рекомбинация двух радикальных частиц, полученных из этилена и аминогруппы, совершается в два этапа. Сначала происходит фронтальное перекрывание и смешивание однократно занятыхsp2иpxорбиталей частиц, которое завершается образованием-связи (предыдущий пример). Затем в молекуле совершается вынужденное смешивание- и*- МО этилена и pz-АО азота, несущей неподеленную пару электронов, которое завершается формирование трех МО–типа.
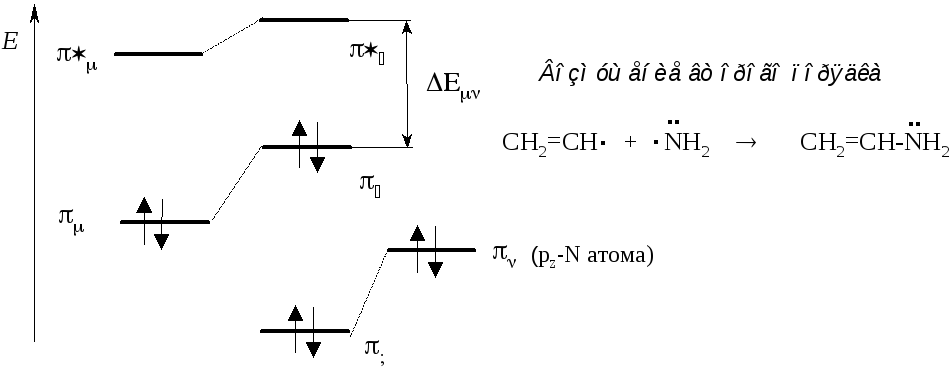
В этом случай из-за значительной разницы в энергии между одной из перекрывающихся орбиталей * и взаимодействие будет сопровождаться возмущением второго порядка и меньшим расщеплением, чем расщепление между и . Поэтому произойдет уменьшение размера энергетической щели между новыми разрыхляющей и высшей занятой МО.
Следует отметить, что взаимодействие между несколькими (три и больше) орбиталями аддитивно и итоговое возмущение не зависит, в какой последовательности рассматривались эти взаимодействия.
