
- •80 Теория цветности органических соединений
- •Часть 1 Теория цветности органических соединений
- •1. Физические основы цветности
- •1.1. Природа света и происхождение цветоощущения
- •1.2. Спектральный способ регистрации поглощенного света и спектральная терминология
- •1.3. Взаимодействие электромагнитного излучения с веществом
- •1.3.1. Конфигурация электронно-колебательных уровней
- •1 Лекция 3.3.2. Принцип Франка-Кондона и форма полос поглощения
- •2. Анализ электронной структуры методами квантовой химии.
- •2.1. Способы описания энергетических состояний молекул.
- •2.2. Основные принципы метода возмущения молекулярных орбиталей
- •2.3. Формирование мо и основные типы электронных переходов
- •3. Экспериментальные методы изучения электронной структуры
- •3.1. Фотоэлектронная спектроскопия
- •3.2. Электронная трансмиссионная спектроскопия
- •4. Основные положения теории цветности
- •4.1. Электронные переходы в молекулах углеводородов
- •4.1.1. Энергии электронных переходов в насыщенных углеводородах
- •4.1.2. Энергии электронных переходов в сопряженных системах
- •4.1.3. Энергия электронных переходов в ароматических углеводородах
- •4.1.4. Альтернантные и неальтернантные -системы
- •4.1.5. Типы возмущений и их влияние на энергию –мо
- •4.2. Электронные переходы в молекулах, содержащих гетероатомы
- •4.2.1. Переходы в гетероцепных четных альтернантных системах
- •4.2.2. Переходы в гетероцепных нечетных альтернантных системах
- •4.3. Влияние поляризующих заместителей на поглощение света сопряженными системами
- •4.3.1. Классификация заместителей
- •4.3.2. Электронодонорные заместители
- •4.3.3. Электроноакцепторные заместители
- •4.3.4. Совместное действие поляризующих эд и эа заместителей
- •4.3.5. Полосы переноса заряда
- •4.4. Влияние ионизации на поляризующее действие заместителей
- •4.4.1. Ионизация эд-заместителей
- •4.4.2. Ионизация эа-заместителей
- •4.4.3. Ионизация сложных молекул
- •4 Лекция 9.5. Сложные конкурирующие и перекрещивающиеся сопряженные системы
- •4.5.1. Разветвленные сопряженные системы
- •4.5.2. Объяснение спектральных закономерностей при образовании разветвленных сопряженных систем методом возмущения мо
- •4.5.3. Перекрещивающиеся сопряженные системы
- •4 Лекция 10.6. Влияние пространственных факторов на поглощение света
- •4.6.1. Нарушение копланарности сопряженной системы
- •4.6.2. Искажение валентных углов
- •4.7. Комплексообразование с металлами
- •4.7.1. Комплексообразование с углублением цвета
- •4.7.2. Комплексообразование без углубления цвета
- •5. Хромофорная система красителей
1.3.1. Конфигурация электронно-колебательных уровней
Образование ковалентной связи между двумя атомами XиY сопровождается:

повышением электронной плотности в области между ядрами;
сближением атомов с их фиксацией на определенном расстоянии r0, которое соответствует длине этой связи;
понижением энергии молекулярной системы на величину, равную энергии образовавшейся связи.
Таким образом, электронная энергия связи для двухатомной молекулы является функцией межъядерного расстояния,Епот=f(rx-y).
Графически такую зависимость можно представить в виде характеристической кривой, имеющей форму искаженного параболоида, с энергетическим минимумом над точкой равновесного межъядерного расстояния r0. Эта энергетическая кривая соответствуетсвязывающей молекулярной орбитали.
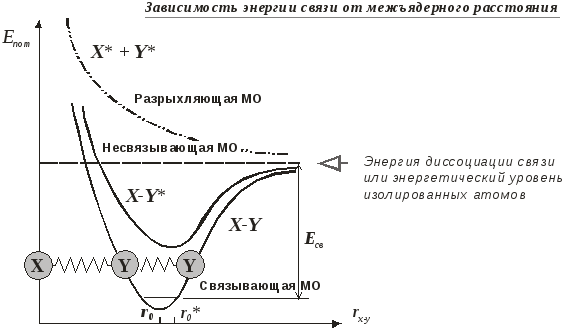
Минимум на кривой возникает потому, что при дальнейшем сближении атомов начинают преобладать силы межъядерного отталкивания. Расхождение атомов на большее расстояние также требует дополнительной энергии для преодоления сил ковалентного связывания. По мере увеличениямежъядерногорасстоянияправая ветвь кривой приближается к энергетическому уровню изолированных атомов и, наконец, наступаетдиссоциация молекулы. Таким образом, разность между уровнем энергии диссоциированных атомов и нулевым уровнем молекулы соответствует энергии данной связиЕсвили равна энергии диссоциацииЕдис, взятой с обратным знаком.
Если сближение атомов не сопровождается возникновением связи между ними, характер энергетической кривой существенно изменяется. По мере уменьшения межъядерного расстояния rx-yсилы отталкивания ,быстро нарастают, и энергетическая кривая приобретает виды экспоненты, что соответствуетразрыхляющей молекулярной орбитали.
В возбужденном состоянииэлектрон заселяет более высоко расположенный вакантный электронный уровеньи осуществляетодноэлектронную связьв молекуле. Энергия такой связи значительно меньше обычной двухэлектронной связи, поэтому длина связиr0несколько увеличивается. При этом соответствующая кривая зависимости энергии от межъядерного расстояния, хотя и сохраняет форму параболоида, потенциальная яма становится менее глубокой и её правый склон более пологим. Понятно, что для высших возбужденных электронных состояний эта тенденция еще больше усиливается и, в конце концов, межатомная связь практически исчезает, а параболическая кривая превращается в экспоненту.
Для многоатомной молекулызависимостьЕпотот межъядерных расстояний превращается вмногомерную гиперповерхность, которая имеет энергетические минимумы, соответствующие равновесным конфигурациям атомов. Гиперповерхность описывается в многопараметровой системе координат. Такая модель сложна и не обладает наглядностью.Поэтому приближенно используют сечение потенциальной гиперповерхности по координате наиболее слабой в данной молекуле связи.Эта координата сильнее других изменяется в ходе фотофизических процессов. Таким образом, многомерный случай сводят к двухмерному, который рассмотрим более подробно.
Спектр поглощения органических соединений состоит из широких полос, а не из узких линий. Это объясняется тем, что любая молекула при фотовозбуждении изменяет не только электронную, но и колебательную энергию.
Колебаниясвязанных ядер вдоль межъядерной оси можно рассматривать как колебания ядраYотносительно неподвижного ядраX. При небольших отклонениях ядраY от положения равновесияroмолекулу приближенно рассматривают какгармонический осциллятор, а зависимость величины потенциальной энергииЕпотот отклонения ядер изображается искаженным параболоидом (т.н.кривая Морзе). Общая колебательная энергия ядер - сложная величинаЕкол=Епот +Екин
Из-за относительно малой массы ядер, их колебания квантуются.
Для данного электронного состояния колебательная энергия принимает лишь определенные величины в соответствии со значениями колебательных квантовых чисел v= 0,1,2,3… и может быть вычислена по уравнению Морзе.

Из этого уравнения следует, что низшая колебательная энергия - энергия нулевого колебательного уровня отлична от нуля, так как Екол(0)h.
Теперь рассмотрим некоторые свойства потенциальной кривой электронного состояния колебательной системы.
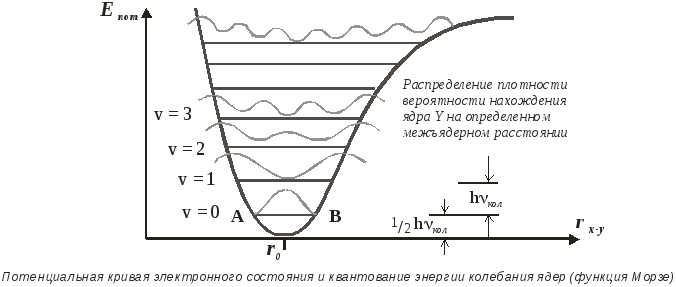
Точки пересечения разрешенных колебательных уровней полной энергии с потенциальной кривой (например, точки А и В) можно сопоставить с точками максимальной амплитуды колебаний гармонического осциллятора. В этих точках вся кинетическая энергия осциллятора превращается в потенциальную энергию. В промежуточных точках горизонтальных отрезков кинетическая энергия колеблющихся атомов отличается от нуля. Согласно уравнению при возрастании колебательного квантового числа колебательные уровни сближаются.
В виде синусоидальных кривыхна рисунке показанораспределение плотности вероятности нахождения ядра Yна определенном межъядерном расстоянии. При повышении колебательной энергии возрастает вероятность нахождения ядра вблизи потенциальной кривой. Напротив, на нулевом колебательном уровне максимум вероятности нахождения ядраYсовпадает с равновесным межъядерным расстояниемr0.
Форма потенциальной кривой особенно сильно отличается от симметричной параболыв области малых межъядерных расстояний. Вследствие эффекта отталкивания ядер она круто идет вверх. В области больших межъядерных расстояний из-за ослабления ковалентной связи кривая идет более полого. Поэтому энергетику потенциальной кривой описываютфункцией Морзе, которая при определении колебательной энергии учитывает энергию диссоциации связи.
