
- •22(10) 10. 00Индигоиды0
- •10. Индигоидные красители
- •10.1. Строение и хромофорная система Индиго
- •10.1.1. Строение хромофора
- •10.1.2. Межмолекулярные взаимодействия
- •10.1.3. Конформационный эффект
- •10.2. Закономерности цвета в производных Индиго
- •10.2.1. Природа гетероатома
- •10.2.2. Несимметричные индигоиды
- •10.2.3 Влияние заместителей
- •10.3. Области применения индигоидов
- •10.4. Бис(индол)индигоиды
- •10.5. Бис(бензотиофен)индигоиды
- •10.6. Несимметричные индигоидные красители
- •10.6.1. Индолбензотиофениндигоиды
- •10.6.2. Индоларен- и бензотиофенарениндигоиды
10.5. Бис(бензотиофен)индигоиды
Тиоиндигоиды - аналоги Индиго содержат в своих молекулах тиофеновые остатки, конденсированные с бензольными и нафталиновыми ядрами. Заменав гетероциклическом ядре красителя атома азотана серу, имеющую меньший электронодонорный эффект, приводит к меньшей поляризации Аш-хромофора и заметномуповышениюцвета. Среди тиоиндигоидов преобладают красители фиолетового, красного, оранжевого и коричневого цвета.
В отличие от Индиго тиоиндигоидные красители восстанавливаются в лейкосоединение не только дитионитом натрия, но ирастворамисульфиданатрия, что сближает их по способу крашения с сернистыми красителями. Это позволяет применять их совместно с ними, для воспроизведения оттенков красного цвета, которые не могут быть получены с помощью сернистых красителей.
Тиоиндигоидные красители, которые восстанавливаются в лейкосоединение Na2S2O4 в водно-аммиачной среде и при низкой температуре, используются для окрашивания шерстяной пряжи и меха.
Несмотря на широкую цветовую гамму тиоиндигоидов и большую, чем у Индиго, устойчивость к химическим воздействиям, окраски не отличаются особой яркостью. Поэтому эта группа красителей утрачивает коммерческое значение из-за сложности синтеза и большей себестоимости по сравнению с другими кубовыми красителями.
Практически важными в группе тиоиндигоидов являются симметричные красители. Синтез их сводится к получению 3-гидроксибензотиофенаили его замещенных, которые затем окисляют. Подобно индоксилу 3-гидроксибензотиофен может существовать в таутомерныхоксо-(кето) игидрокси-(енольной) формах.

В качестве окислителейобычно применяют серуS8или полисульфид натрияNa2S2в щелочной среде, чтобы исключить окисление атома серы в гетероцикле, которое возможно при действии кислорода воздуха и образующегося пероксид-аниона.
Способы получения тиоиндигоидных красителей отличаются большим разнообразием, это относится к методам введения в ароматическое ядро меркаптогруппы и циклизации соответствующей арилтиогликолевой кислоты в 3-гидроксибензотиофен.
Синтез с использованием диазореакции
Способ заключается в замене аминогруппы в ароматическом ядре на меркаптогруппу через диазосоединение. Таким способом получают краситель - Тиоиндигокрасный С.
Исходным продуктом в схеме синтеза этого красителя является антраниловаякислота. Её диазотируют при 5-10OC обратным методом, диазосоединение медленно вносят в охлажденный до 0OC раствор дисульфида натрияNa2S2иNaOH. Образующийся диазодисульфид разлагается при 20OC с выделением азота, давая динатриевую соль дитиосалициловой кислоты, которая при 90OC восстанавливается натриевую соль тиосалициловой кислоты.

После удаления сульфидов раствор подщелачивают и проводят S–алкилирование монохлоруксусной кислотой.


Из-за наличия в орто-положении фенилтиоуксусной кислоты COOH-группы, принимающей участие в образовании тиофенового кольца, циклизация происходит легче, чем в случае фенилглицина в производстве Индиго.
Циклизацию (2-карбоксифенилтио)уксусной кислотыведут при 170OC в концентрированном водном раствореNaOHиKOH.

Щелочной плав выливают на воду, частично нейтрализуют 20%-ой H2SO4и щелочной раствор динатриевой соли 3-гидрокситиолфен-2-карбоновой кислоты окисляют серой при 90С. ВыпавшийТиоиндиго красный Сочищают от серы нагреванием в растворе NaHSO3и превращением её вNa2S2O3. Краситель также применяют для крашения хлопка и шерсти, а под названием Пигмент красный тиоиндигоидный Сиспользуют в полиграфии и получения акварельных красок.
Синтез с использованием хлорида серы S2Cl2
В основе этого метода лежит реакция Герца: взаимодействие первичных ариламинов со свободным орто-положением с S2Cl2, приводящее к образованиюхлористого1,2,3-бензо[d]дитиазолия- серосодержащего гетероцикла, который при обработке водной щелочью превращаетсяорто-аминотиофенол, используемый затем для синтеза тиоиндигоидных красителей.

Тиоиндиго розовый 2Сполучают по этой схеме, исходяиз гидрохлорида анилина. Его осернение сопровождается хлорированием впара-положение к атому азота.
Реакцию проводят следующим образом. В раствор хлорида серыв ледяной уксусной кислоте на холоду постепенно загружают гидрохлорид анилина и температуру медленно поднимают до 80С. Процессы гетероциклизации и хлорирования протекают в соответствии с представленной ниже схемой.


В гетероцикле наряду с атомами серы в делокализации положительного заряда принимает участие и бензольное ядро. Благодаря возникновению + заряда в положении 6, сюда присоединяется хлорид-анион и образуется нейтральный аддукт.

В реакционной смеси присутствует дитиохлорид-катион, который выступает как акцептор гидрид-аниона (). Он стимулирует гидридное перемещение и аддукт превращается в6-хлор-1,2,3-бензодитиазолий хлорид.
В реакции Герца может происходить не только замещение водорода, расположенные в пара-положении анилина NO2- и CN-группы и другие ЭА группы замещаются на хлор. Напротив, ЭД заместители (CH3-, C2H5O-группы), затрудняющие нуклеофильную атаку, сохраняются.
По окончании реакции массу выливают на воду и лед, при этом происходит гидролиз гетероциклического катиона и образуется 6-хлор-3H-1,2,3-бензо[d]дитиазолоксид-2.

Осадок отфильтровывают, промывают от кислоты водой, суспендируют в ледяной воде, добавляют растворы Ca(OH)2 иNa2S2O4, которые исполняют роль антиоксиданта. Затем в смесь вносят растворхлоруксусной кислотыв водномNaOH.
В процессе реакции происходит расщепление гетероцикла и S-алкилирование образующейся натриевой соли 4-хлор-2-меркаптоанилина.

Без выделения натриевую соль 5-хлор-2-аминофенилтиоуксусной кислотыдиазотируют, применяя обратный порядок, и раствор диазосоединениия при 10oC смешивают с комплексной солью цианида меди. По реакции Зандмейера диазогруппа замещается на CN-группу, образовавшуюсянатриевую соль 5-хлор-2-цианфенилтиоуксусной кислоты высаливают и направляют нациклизацию.
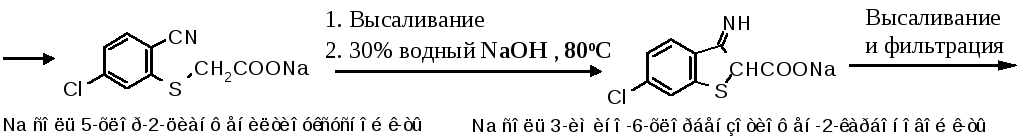
Замыкание тиофенового цикла при наличии орто-положении в фенилтиоуксусной кислоте циангруппы происходит еще легче, чем в предыдущей схеме. При нагревании при80oCв 30%-ой водном раствореNaOHобразуется натриевая соль 3-имино-6-хлорбензотиофен-2-карбоновой кислоты. Продукт выделяют высаливанием, для очистки растворяют в разбавленном растворе соды и раствор обрабатывают активированным углем.

Затем проводят гидролиз и декарбоксилирование иминосоединения. Профильтрованный раствор подкисляют H2SO4и нагревают от 30С до 80С, образующаяся оксокислота далее теряет СО2иоксохлорбензотиофенвыпадает при охлаждении.
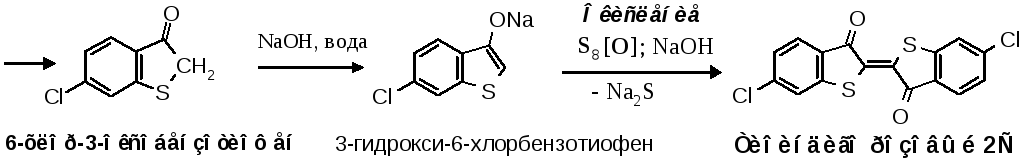
Его отфильтровывают и окисляют в Тиоиндиго розовый 2С в растворе NaOH при 85-90С действием серы.
По аналогичной схеме из солянокислого пара-фенетидина синтезируют менее светостойкийТиоиндиго оранжевый КХ, и на его основе получаютКубозоль оранжевый К. Введение сильного ЭД заместителя впара-положение к карбонильной группе вызывает повышение цвета этого красителя и некоторое понижение яркости и светостойкости окрасок.Однако крашение волокна можно проводить из слабощелочной красильной ванны и при низкой температуре, что является достоинством этого красителя.

Синтез из сульфокислот
По этой схеме промежуточный арилмеркаптан получают из натриевой соли сульфокислоты, превращая ее в сульфонилхлорид и восстанавливая последний Zn в водной серной кислоте. Метод обычно применяют для синтеза меркаптосоединений нафталинового ряда.
Ar-SO3Na Ar-SO2Cl Ar-SH
Эти стадии и последующие превращения арилмеркаптана проводят в среде хлорбензола, без выделения продуктов реакции, что существенно упрощает и облегчает производственный процесс.
При производстве Тиоиндиго красно-коричневого Ж исходят из натриевой солинафталин-2-сульфокислоты (-соли)(Ворожцов, Фридлендер 1912 г).
Предварительно в эмалированном аппарате получают PСl5, пропускаяCl2через раствор треххлористого фосфора в хлорбензоле. Затем вносят сухую порошкообразную натриевую соль нафталин-2-сульфокислоты и смесь нагревают от 60 до 125OC. Хлорбензольный растворнафталин-2-сульфохлорида обрабатывают порошкообразным цинком в присутствии 20%-ой серной кислоты. Хлорбензольный раствор2-меркаптонафталинаотделяют от водно-кислотного слоя, промывают горячей водой и приливают к нагретому до 50°С водномуNaOH, содержащему антиоксидантNa2S2O4.S‑алкилирование осуществляют при 50-55°С добавлением к перемешиваемой эмульсии хлоруксусной кислоты.


Водно-органическую смесь подкисляют HCl и раствор (нафтил-2)тиоуксусной кислоты в хлорбензоле отделяют от водного слоя, высушивают, действиемPCl3переводят в хлорангидрид и подвергают циклизации с помощью хлористого алюминия.


После отгонки хлорбензола и очистных обработок водно-щелочного раствора натриевой соли 3-гидроксинафто[2,1-b]тиофена проводят его окисление в краситель при 30oC, барботируя воздух через раствор, к которому добавлен сульфат меди в качестве катализатора.Перед фильтрацией красителя проводят очистную обработку хлором
По устойчивости окрасок на хлопке и шерсти Тиоиндиго красно-коричневый Жпревосходит другие тиоиндигоидные красители. Под названием Кубовый красно-коричневый 4ЖМ его используют для крашения меха. На его основе также получаютКубозоль красно-коричневый Ж.
