
ХИМИЯ(А2)ДЗ_2сем.2015-16 / ДОМ.ЗАДАНИЯ / ДЗ-3_Атом, Химсвязь(24)
.doc
Две задачи и один вопрос по теме «Строение атома и химическая связь»
Задача 1. На основе метода ВС предположить пространственное строение молекулы и определить является ли молекула диполем:
-
SnCl2
-
HgCl2
-
CdF2
-
PH3
-
BF3
-
PCl3
-
SiH4
-
CCl4
-
CH3F
-
CH2F2
-
AlCl3
-
ZnCl2
-
NF3
-
GaF3
-
H2Te
-
PbCl2
-
BCl3
-
PF3
-
SiF4
-
AlF3
-
CdCl2
-
GeCl4
-
AsH3
-
BCl3
Электроотрицательность элементов
-
Элемент
Al
B
C
Cd
Cl
F
Ga
H
1.5
2.0
2.5
1.7
3.0
4.0
1.6
2.1
Элемент
Hg
N
P
Pb
Si
Sn
Zn
О
1.9
3.0
2.1
1.9
1.8
1.8
1.6
3.5
Пример.
CO2 , О=С=О (атомы кислорода равноценны и связаны с углеродом двойной связью). О = 3.5 С=2.5
-
Электронные конфигурации внешних уровней атомов, образующих молекулу.
С …2s22p2 O …2s22p4
-
2s
2px
2py
2pz
2s
2px
2py
2pz
-
Определить электроны, за счет которых будет образовываться химическая связь.
С – все четыре электрона (2s22p2 2s2p3) О – по два р-электрона
-
Определить необходимость гибридизации и ее тип.
Поскольку С имеет две двойные связи, одна из них должна быть - связью (рy- и pz-электроны), и атомы О равноценны, то оставшиеся s- и px- электроны гибридизуются (sp-гибридизация).
-
Определить пространственную ориентацию гибридных орбиталей
sp-гибридные орбитали имеют линейную симметрию (угол связи 180).
-
Определить пространственное расположение атомов и характер связей.
Молекула CO2 линейна. Атом С по оси x связан с каждым О одной -связью (перекрывание sp-гибридных орбиталей С и px-орбиталей О), а рy- и pz-орбитали перекрываются с р-орбиталями атомов кислорода по -типу
-
Поляризация связи.
О = 3.5 С=2.5 - связи поляризованы на С избыточный +-заряд, на О -заряд.
-
Вследствие линейного строения молекулы CO2 центры тяжести + и совпадают, она не является диполем.
Задача 2. Используя принципы метода МО, составить энергетическую диаграмму молекулы, написать электронную конфигурацию и определить кратность связи:
-
He2
-
He2+
-
Ве2
-
С2
-
N2
-
O2
-
F2
-
Ne2
-
BN
-
CN
-
CN+
-
NO
-
NO+
-
CO
-
Li2
-
Ne2+
-
CO+
-
BN+
-
CO-
-
O2+
-
В2
-
CN-
-
O2-
-
Ве2+
Пример.
А) Молекула Cl2
-
Электронные конфигурации внешних уровней атомов Сl, образующих молекулу Cl2: Сl…3s23p5
-
Определение электронов, образующих молекулярные орбитали(МО). Составление энергетической диаграммы – вариант (а).
*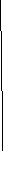 Молекулы атомов второго периода с Z
7 за счет
взаимодействия s- и px–орбиталей
имеют другой энергетический порядок
расположение МО – вариант (б):
Молекулы атомов второго периода с Z
7 за счет
взаимодействия s- и px–орбиталей
имеют другой энергетический порядок
расположение МО – вариант (б):
А) Б)
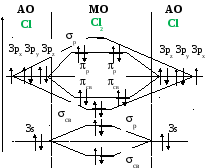
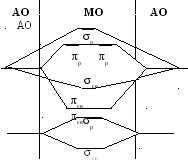
-
Заполнение молекулярных орбиталей электронами.
Суммарное число электронов распределяют по МО с учетом принципов заполнения электронных орбиталей
s – электроны 4 шт. (2 + 2) св – 2 р – 2
р – электроны 10 шт. (5 + 5) св – 4 св – 2 р – 4
-
Электронная конфигурация молекулы.
св2р2св4св2р4
-
Кратность связи: 8 электронов на связывающих орбиталях, 6 – на разрыхляющих КС = (8 - 6)/2 = 1
-
Молекула диамагнитна (нет неспаренных электронов)
Вопрос №3
-
Квантово-механическое описание состояния электрона.
-
Физический смысл волновой функции.
-
Энергетические состояния электрона в атоме.
-
Квантовые числа и энергетические состояния электрона.
-
Электронная орбиталь.
-
Электронные орбитали в многоэлектронном атоме.
-
Электронные конфигурации атомов и их связь с положением элементов в периодической таблице.
-
Физико-химические характеристики атомов.
-
Основные характеристики химической связи.
-
Классификация и способы описания химической связи.
-
Основные принципы метода ВС.
-
Донорно-акцепторный механизм образования ковалентной связи.
-
- и - связи.
-
Кратность связи.
-
Гибридизация атомных орбиталей.
-
Метод молекулярных орбиталей
-
Полярность связи, дипольный момент молекулы.
-
Межмолекулярное взаимодействие.
-
Энергия связи и длина связи.
-
Квантовые числа и электронные орбитали.
-
Водородная связь.
-
Электронное строение атомов и Периодический закон.
-
Принципы заполнения электронных орбиталей в атоме.
-
Принцип Паули и правило Хунда.
