
- •Химическое равновесие
- •Энергия Гиббса реакции в нестандартных условиях
- •Константа равновесия К, её размерность. Связь между К (кинетич.) и стандартной К 0
- •Динамическое равновесие
- •Расчет равновесного состава(концентраций) газовой смеси
- •Равновесие в растворах(дисперсных системах)
- •Электролитическая диссоциация
- •Ионное произведение воды
- •Водородный показатель
- •Многоосновные кислоты и основания
- •Примеры гидролиза солей
- •Произведение растворимости - ПР
- •Число компонентов – К
- •Примеры процессов.
- •Кипение и кристаллизация растворов
- •Эбуллиоскопические и криоскопические постоянные некоторых растворителей
- •Изотонический коэффициент – i (растворы электролитов)

Химическое равновесие
Термодинамические параметры: T; P; i; Сi – const
|
1. Термодинамическое условие равновесия - |
rG = 0 |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|||||||
|
2. Кинетическое условие равновесия - |
|
v v |
|
|
|
|||||||||
|
|
|
|
реакция |
A + B C + D |
|
|
|
|
||||||
|
|
|
|
|
|
|
а |
b |
с |
d |
|
|
|
|
|
|
|
v |
k СA |
a СB |
b |
|
v k СC |
c СD |
d |
||||||
|
|
|
|
|
|
|
k СA a СB b k СC c СD d |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
|
|
(СC )р c (СD )р d |
|
|
|
|
|
|
|
|
|
|
|
K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
k |
|
|
(СA )р a (СB )р b |
Константа равновесия[f(T)] |
|
||||||
|
|
|
|
|
|
(кинетические условия) |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Энергия Гиббса реакции в нестандартных условиях
|
реакция |
|
|
|
|
|
|
|
|
аA + bB = сC + dD |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
G0 |
= ( |
G0 |
+ |
|
G0 |
|
) – ( |
a |
|
f |
G0 |
|
+ |
|
G0 |
B |
) |
С0 =1 моль/л |
||||||||||||||||||||||||
|
|
r |
|
|
|
|
c |
|
f |
|
|
C |
|
|
|
d |
|
|
f |
|
D |
|
|
|
|
A |
|
b |
f |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
С С0 |
|
|
|
|
|
|
|
|
|
G |
|
= |
|
G0 |
i |
+ |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
p |
|
|
с |
|
|
|
|
|
|
|
|
r |
i |
|
|
|
r |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Сi Xi |
|
R T lnC |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
i |
|
|
i |
|
|
|
|
i |
– |
|
безразмерная концентрация |
|
|
||||||||||||||||||||||||||
|
p0 |
с0 |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
X i |
|
|
|
i |
|
|
|
– |
|
|
мольная доля; |
|
|
|
|
|
|
Сi – [ моль/л ] |
|
||||||||||||||||||||||
|
|
|
i |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
pi |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
– относительное парциальное давление [атм], p0 =1,013.105 Па |
||||||||||||||||||||||||||||||||||||||||
|
|
p0 |
|
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
G = ( |
|
G0 |
|
+ |
G0 |
|
) – ( |
|
G0 |
|
+ |
G0 ) + R T ( |
lnС + |
lnC – |
||||||||||||||||||||||||||||
r |
|
|
|
c |
|
|
f |
|
C |
|
|
|
d |
|
f |
|
|
D |
|
|
|
a |
|
f |
A |
|
b |
|
|
f |
|
|
B |
|
|
|
c |
|
C d |
D |
|||
a lnCA– b lnCB) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СC vc СD vd |
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
rG rG |
0 |
R T ln |
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
СA va СB vb |
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||

4.7 Равновесие – термодинамические условия ( rG = 0)
|
|
rG rG0 R T |
|
|
|
|
|
(СC ) р vc (СD ) р vd |
|
|
|||||||||||||
|
|
ln |
|
|
|
|
|
|
0 |
|
|
||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(СA ) р va (СB ) р vb |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
K |
0 |
|
(СC )рvc |
(СD )рvd |
|
|
|
|
|
Стандартная(термодинамическая) |
|||||||||||
|
|
|
(СA )рva |
(СB )рvb |
|
|
|
|
|
константа равновесия хим.реакции |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
rG0T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
G0 |
+ R T lnK0 = 0 |
|
|
|
|
|
|
lnK0 rG |
Т |
|
|
|
K0 e |
R T |
|||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||
r T |
|
|
|
|
|
|
|
|
|
|
|
|
|
R T |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
rG0T = rН0T – Т rS0T |
|
|
|
|
|
|
lnK0 r H0Т |
rS0Т |
|
|
|||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R T |
R |
|
|
||||

Константа равновесия К, её размерность. Связь между К (кинетич.) и стандартной К 0 (термодинам.)
K(СC )р c (СD )р d (СA )р ba (СB )р
К≡KX - концентрации задаются мольными долями [безразмерная величина]
К≡Kp - концентрации задаются парциальными давлениями - [(Па) ]
= ( c+ d) - ( a+ b)
К≡KC – концентрации задаются молярной концентрацией - [(моль/л) ]
|
|
|
|
|
p |
|
|
|
|
0 |
|
0 |
|
|
|
|
|
0 |
|
R T |
|
|
K |
X |
K0 ( |
|
) |
K |
p |
K |
|
(p |
) |
|
KC K |
|
( |
|
) |
|
|||||
|
|
|
|
p0 |
|
|||||||||||||||||
p0 |
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
p/p |
0 |
|
~ |
физ.атм., относит.давл. |
р |
0 |
= 1,013 10 |
5 |
Па |
|
|
|
|
|
||||||||
|
p |
|
|
|
|
|
|
|
||||||||||||||
стандарт.давление

|
|
|
Сдвиг равновесия |
|
(СC )р vс (СD )р vd |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
К0 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Изобара реакции |
|
|
|
|
|
(СA )р va (СB )рcb |
|||||||||||
|
Р-const |
|
|
|
|||||||||||||
lnK |
0 |
|
|
H0Т |
|
|
S0 |
Т |
|
|
|
dlnK0 |
|
r H0 |
|||
|
|
r |
|
|
r |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
dT |
R T2 |
|||||||||
|
|
|
|
R T |
|
R |
|
|
|
|
|
||||||
rН0 0 (экзотерм.реакция) – K0(T) убывающая функция(↑Т, К0↓)
rН0 0 (эндотерм.реакция) – K0(T) возрастающая функция(↑Т, К0↑)
Изотерма реакции T-const
rG rG0 R T ln СC vc СD vd 0
СA va СB vb
rG R T (ln СC c СD d - lnK0 ) СA a СB b
rG0T = – R T lnK0
rG<0rG>0rG=0
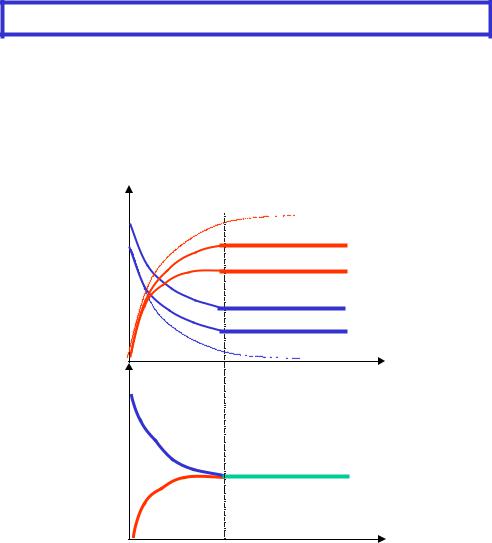
Динамическое равновесие
реакция аA + bB сC + dD
t= 0 |
CA= (CA)0 CB= (CB)0 |
CE= 0 |
CD=0 |
С |
|
|
|
(CA)0 • |
|
(CD)p |
|
(CB)0 • |
|
|
|
|
|
(CE)p |
|
(CD)0 |
|
(CA)p |
|
|
(CB)p |
|
|
(CE)0 |
|
|
|
|
t |
|
|
v • |
|
|
|
• |
v |
|
|
|
v v |
• v |
t |
0 |
tрав |

Расчет равновесного состава(концентраций) газовой смеси
|
1. Расчет К0(Т) Для определенной Т рассчитывают |
|
||||||||
|
G0(T)= |
H0(T) –Т· |
S0(T). Затем |
|
||||||
|
r |
r |
|
|
r |
|
|
|
||
|
|
K0 (T) e |
G0 (T) |
|
||||||
|
|
R T |
|
|
|
|||||
|
2. Расчет КX или Кр |
|
|
|
|
|
|
|
||
|
КX Xi при Р –const |
|
|
|
|
|
Кр рi - при V - const |
|||
|
(р0 = 1,013 105 Па-стандартн.давление) |
|
|
|
|
|||||
|
|
|
|
|
||||||
|
KX (T, p) K0 (T) ( |
p |
) |
|
|
|
|
|
Kp (T) K0 (T) (p0 ) |
|
|
|
|
|
|
||||||
|
0 |
|
|
|
|
|
||||
|
|
p |
|
|
|
|
|
|
|
|

|
Пример. |
Диссоциация АВ при Р -const и температуре Т |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
АВ |
|
= |
|
|
А + |
|
В |
|||||||||||
|
|
|
|
t=0 |
САВ |
|
|
|
|
|
0 |
|
|
|
0 |
|
|
|
|
||||
равновесие |
ni |
САВ-z |
|
|
|
|
|
z |
|
z |
|||||||||||||
Xi |
САВ |
z |
|
|
|
|
z |
|
|
z |
|
||||||||||||
|
|
|
|
САВ z |
|
|
|
|
САВ z |
|
САВ z |
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
Xi |
ni |
|
ni (САВ z) (z) (z) САВ z |
|||||||||||||||||||
|
ni |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
KX |
|
z z (САВ z) |
|
|
|
|
|
|
|
z2 |
|
|
|
|
|
|
|
|||||
|
(САВ z) (САВ z) (САВ z) |
САВ2 z2 |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
2 |
|
|
2 |
|
|
|
|
|
|
K X САВ2 |
|
||||||
|
K X САВ |
K X z |
|
z |
|
|
|
|
|
z |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
K X 1 |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Равновесие в растворах(дисперсных системах)
Раствор - гомогенная однофазная многокомпонентная система, образованная двумя или более веществами. По агрегатному состоянию - газовые,
жидкие и твёрдые растворы. Основн. способ получения жидк.р-ров - растворение
А - растворенное вещество-твёрдое, жидкое, газ  (дисперсная фаза)
(дисперсная фаза)
А+В |
В – растворитель (дисперсионная среда) |
|
|
|
А+В – раствор (дисперсная система) |
|
Концентрация раствора – важная характеристика раствора (относительное соотношение количеств растворенного вещества и растворителя)
•массовая доля % |
mA |
100% |
|
• |
мольная доля X % |
A |
100% |
||||||
|
|
||||||||||||
mA B |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
A B |
|
||
•молярная концентрация |
СМ |
А |
|
|
[ |
моль |
] |
|
|
|
|||
VA B |
|
л |
|
|
|
||||||||
•нормальная концентр. |
|
|
|
|
|
|
|
||||||
• |
Сm |
|
А |
|
[ |
моль |
] |
|
|
||||
моляльная концентрация |
|
|
|
|
|
|
|
|
|||||
•массовая конц. (г/л), процент.конц.mB |
|
|
кг |
|
|
|
|||||||
Электролитическая диссоциация
АВ A+ + B- |
|
|
|
|
|
|
|
|
|
|
|
|
|
С0 - общая концентрация |
|
|
|
|
||||||||||||||
|
|
|
|
АВ A+ + B- |
|
СД - конц.молекул в виде ионов |
||||||||||||||||||||||||||
A+ + B- AB |
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
СД = [A+]=[B-]=αС0 |
|
|
|
[AB]=С0-αС0 |
||||||||||||||||||
Степень диссоциации - |
|
|
|
Сд |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
С0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
α>50%, <5%, 5<α<50% |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Сильные, слабые, средней силы электролиты |
|
|
|
|
|
|
][B |
|
] |
|
|
|
|
|
|
|
||||||||||||||||
Константа диссоциации(равновесия) –Kд [ A |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
Вместо [Ai] = ai = γi Ci , |
|
|
|
|
|
|
|
|
|
|
|
|
|
[ AB] |
|
|
|
|
|
|
|
|
|
|
||||||||
где ai – активность, γi – коэфф. активности |
|
|
1 |
|
|
|
КД |
|
||||||||||||||||||||||||
[A ][B ] |
С |
|
С |
|
|
|
2 |
С |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
К Д |
|
|
|||||||||||
Kд |
[AB] |
|
|
|
0 |
|
|
0 |
|
|
1 |
0 |
|
|
0 |
|
|
|
|
|
||||||||||||
|
|
С0 |
С0 |
|
|
|
|
|
|
|
К |
д |
= α |
2С |
0 |
С0 |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
