
- •2 ХИМИЧЕСКАЯ СВЯЗЬ
- •2.1 Основные параметры химической
- •Примеры
- •2.2 Классификация химической связи – типы связи
- •2.3 Ковалентная хим.связь
- •2.4 Метод валентных связей (ВС) (на примере молекулы Н2)
- •Решение
- •Интегралы
- •Молекула водорода
- •Принципы (постулаты) метода ВС(на основе представлений при расчете молекулы водорода)
- •Перекрывание валентных АО по - типу ( -связь) -
- •Перекрывание АО по - типу ( -связь) –
- •Кратность связи. Схема образования
- •Примеры
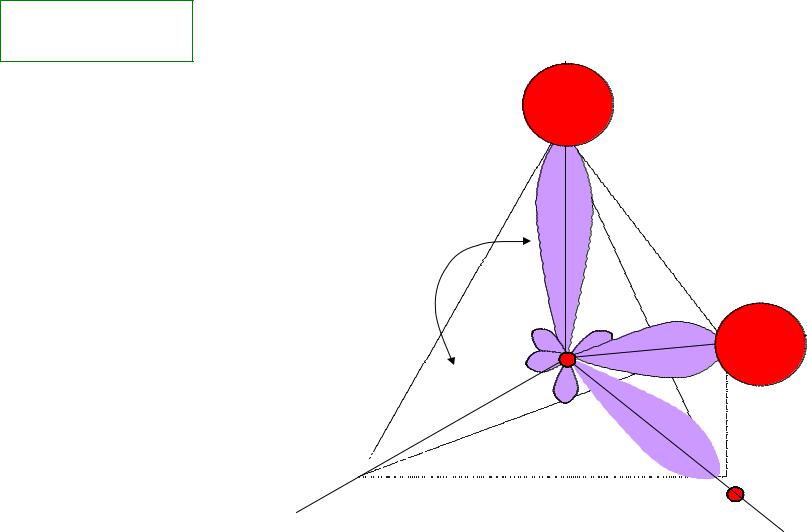
- •2.5 Геометрия простейших молекул (МВС) – следствие ориентации валентных АО в пространстве.
- •Молекулы H2O, H2S, H2Se и величина валентного угла в зависимости от эффективного заряда
- •Теория гибридизации АО(атомных орбиталей)
- •Гибридные орбитали
- •Примеры
- •Пример
- •Пример dsp2-гибридизация
- •2.6 Донорно-акцепторный механизм
- •2.7 Метод молекулярных орбиталей (ММО) Роберт Малликен
- •Энергетическая диаграмма молекулы водорода
- •Правила построения энергетических диаграмм ММО
- •Пример: энергетическая диаграмма молекулы NO
Пример
Н
sp3-гибридизация |
|
молекула АВ4 |
|
СH (...2s12p3) |
|
4 |
109о29' |
тетраэдр |
Н
Н











































































































































 Н
Н
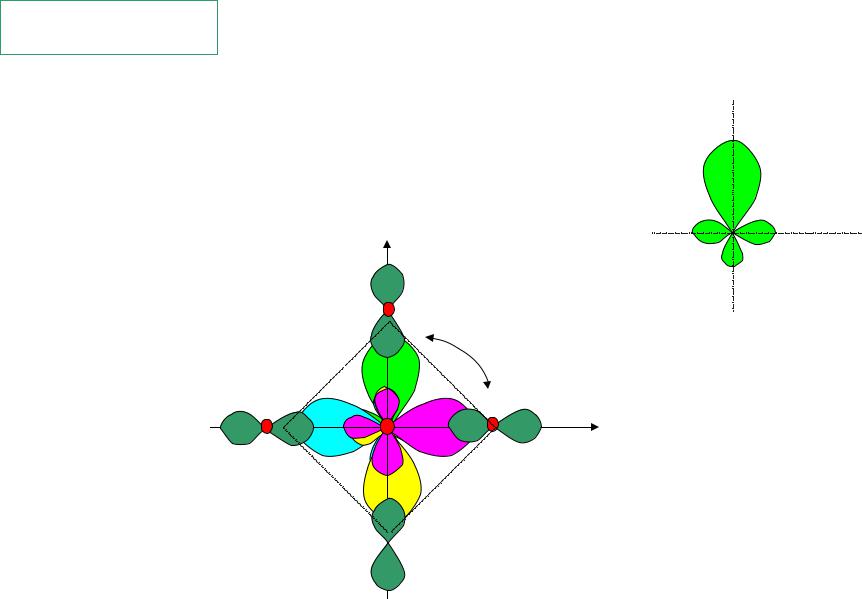
Пример dsp2-гибридизация
молекулярный ион [CuCl4]-2
плоский квадрат
dsp2 |
c1 s c2 px |
c3 py |
c4 |
d 2 |
y |
2 |
|
|
|
|
x |
|
|
|
|
y |
|
|
|
|
|
|
Cl |
90 |
|
|
|
|
|
Cu |
|
|
||
|
|
|
|
|
|
|
Cl |
Cl |
x |
 Cl
Cl
2.6 Донорно-акцепторный механизм
образования ковалентной связи
Молекула СО |
Есв =1071кДж/моль |
по зачению Е - связь тройная |
C |
|
2s2 |
|
2px1 |
2py1 |
2pz0 |
Акцептор - |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
свободная |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
орбиталь |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
2s2 |
|
2px1 |
2py1 |
2pz2 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Донор – |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
неподеленная |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пара |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
электронов |
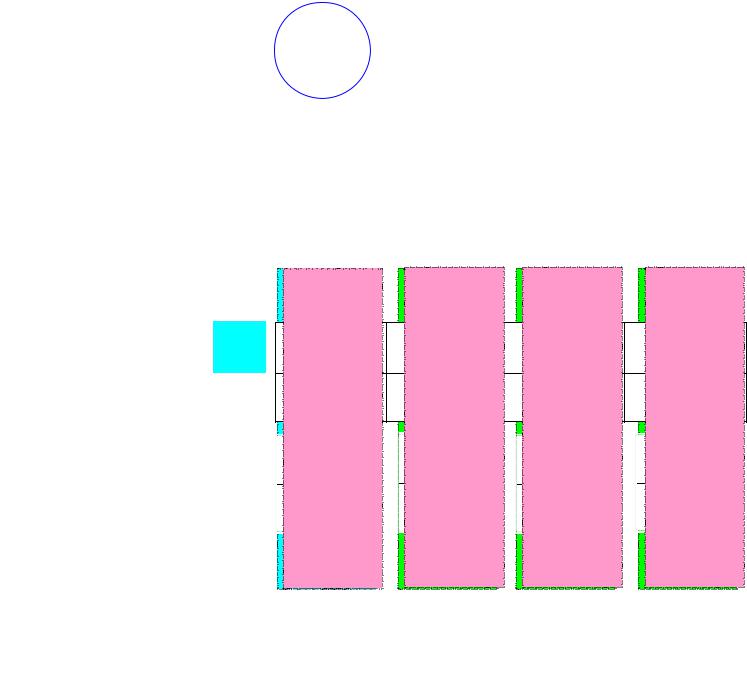
Ион [NH ]+ |
NH + H+ [NH ]+ |
|
4 |
3 |
4 |
Из эксперимента - четыре равноценных атома водорода, тетраэдрическая конфигурация sp3-гибридизация валентных орбиталей атома азота
N 2s22px12py12pz1 |
Н 1s1 |
Н+ 1s0 |
N |
sp3 |
sp3 |
sp3 |
sp3 |
|
1s0 |
|
1s |
|
1 |
|
1s |
|
1 |
|
1s |
|
1 |
|
|
|
|
|
|
|||||||
|
|
|
|
|
||||||||
H+ |
|
H0 |
|
H0 |
|
H0 |
||||||
|
|
|
|
|
|
|||||||

2.7 Метод молекулярных орбиталей (ММО) Роберт Малликен
Принимается:
1.Каждый электрон в молекуле движется в результирующем поле всех ядер и остальных электронов. В ММО - молекула рассматривается как единая частица. (В МВС эл-н в поле своего ядра, молекула-система взаимодействующих изолированных атомов).
2.Состояние электрона в молекуле описывают волновые функции, которые называют молекулярными орбиталями (МО). МО представляет из себя - линейную комбинацию(сложение или вычитание) АО. Сокращенное название МО - (МО-ЛКАО). МО многоцентровые (т.к. в молекуле не менее 2-х ядер) в отличие от АО.
3.Совокупность молекулярных орбиталей в молекуле называется электронной конфигурацией молекулы.
Заполнение электронами молекулярных орбиталей осуществляется на основе принципа
•минимума энергии
•принципа Паули
•правила Хунда
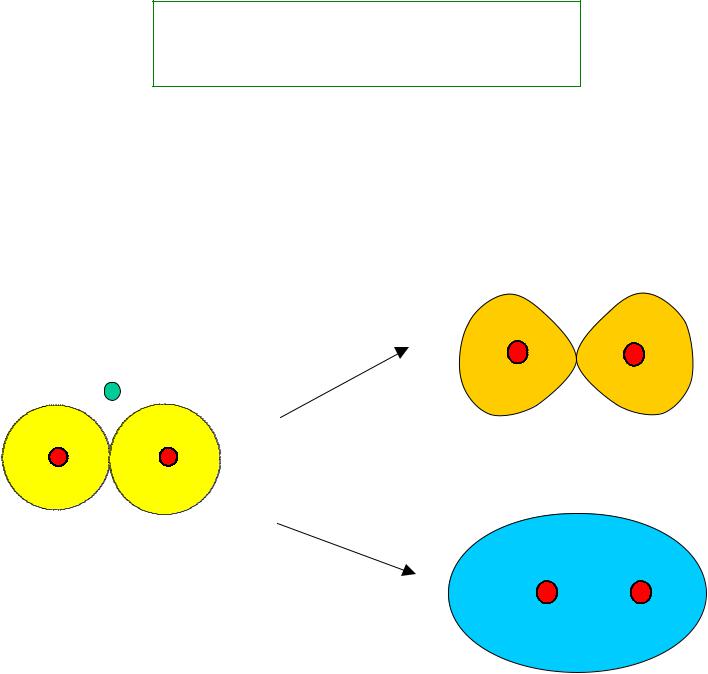
Молекулярные орбитали молекулярного иона Н2+
|
1 c1 ( A B ) |
2 с2 ( А В ), |
|
Атомные 1s орбитали Н2+ |
Молекулярные орбитали Н2+ |
||
|
|
2 - р (разрыхляющая орбиталь) |
|
А - (1s) |
В - (1s) |
с2-нормирующий множитель |
|
|
|
||
-
+ |
+ |
1 - |
св (связывающая орбиталь) |
|
|
||
|
Атом В |
с1- нормир.множитель |
|
Атом А |
|
|
|
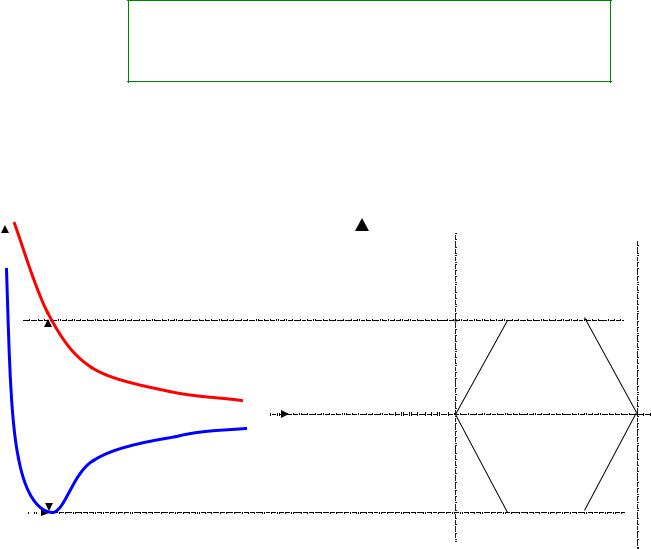
Энергетическая диаграмма молекулы водорода
Е(r) |
|
|
|
|
Е(rсв) |
АО |
МО |
АО |
||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
р |
|
||
|
|
|
|
ΔЕ(r) – разрыхляющая |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
r |
|
1s |
|
|
|
1s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
ΔЕ(r) – связывающая |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
rcв |
|
|
|
|||||||
|
|
|
|
|
|
|
|
св |
|
|||
|
|
|
|
|
|
|
|
|
||||

Правила построения энергетических диаграмм ММО
1. Выбираются АО изолированных атомов, принимающие участие в образовании химической связи (валентные орбитали).
Для s- и p-элементов валентными орбиталями являются ns- и np- электроны.
2. Взаимодействующие АО должны иметь одинаковую симметрию относительно линии связи, при этом число образующихся МО равно
числу АО.
Две ns-атомные орбитали образуют две -молекулярные орбитали. Одна из них связывающая и одна разрыхляющая.
Две np-орбитали образуются две - и четыре -молекулярные орбитали. Из них одна - и две - МО связывающие и соответственно одна - две - разрыхляющие МО
Точное значение энергий МО необходимо рассчитывать, но можно пользоваться качественными схемами энергетических диаграмм молекул.
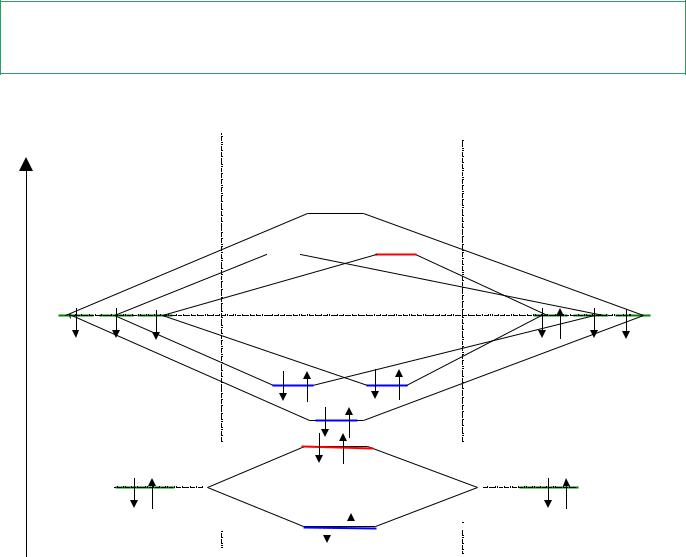
Пример: энергетическая диаграмма молекулы NO
Е(r ) |
АО |
МО |
АО |
||
св |
N |
NO |
O |
||
|
|
|
|
||
|
|
р(px) |
|
|
|
|
|
|
|||
px py pz  р(py)
р(py)
св(py)
pz py px
р(pz)
св(pz)
2s |
св(px) |
р(s) |
2s |
|
|
|
св(s) |
Кратностьсвязи |
|
|
|
|||
|
||||
|
|
|||
|
КС 8 3 |
2.5 |
||
NO [ св(s)]2 [ (s) р]2[ св(px)]2[ св(py)]2[ св(pz)]2[ р(py)]1 |
||||
|
|
|
2 |
|
|
|
|
|
|
Парамагнетик – наличие неспаренных электронов на МО Диамагнетик – отсутствие неспаренных электронов
