
- •2 ХИМИЧЕСКАЯ СВЯЗЬ
- •2.1 Основные параметры химической
- •Примеры
- •2.2 Классификация химической связи – типы связи
- •2.3 Ковалентная хим.связь
- •2.4 Метод валентных связей (ВС) (на примере молекулы Н2)
- •Решение
- •Интегралы
- •Молекула водорода
- •Принципы (постулаты) метода ВС(на основе представлений при расчете молекулы водорода)
- •Перекрывание валентных АО по - типу ( -связь) -
- •Перекрывание АО по - типу ( -связь) –
- •Кратность связи. Схема образования
- •Примеры
- •2.5 Геометрия простейших молекул (МВС) – следствие ориентации валентных АО в пространстве.
- •Молекулы H2O, H2S, H2Se и величина валентного угла в зависимости от эффективного заряда
- •Теория гибридизации АО(атомных орбиталей)
- •Гибридные орбитали
- •Примеры
- •Пример
- •Пример dsp2-гибридизация
- •2.6 Донорно-акцепторный механизм
- •2.7 Метод молекулярных орбиталей (ММО) Роберт Малликен
- •Энергетическая диаграмма молекулы водорода
- •Правила построения энергетических диаграмм ММО
- •Пример: энергетическая диаграмма молекулы NO

Принципы (постулаты) метода ВС(на основе представлений при расчете молекулы водорода)
1) Единичная химическая связь образуется общей парой электронов с противоположными спинами.
Насыщенность – ограниченное число связей, которые может образовывать атом [определяется числом неспаренных (валентных)электронов на внешнем энергетическом уровне атома в основном или возбужденном состоянии]
2) Общая электронная пара локализована(расположена) между атомами в направлении максимального перекрывания атомных орбиталей(минимума потенциальной энергии)
Направленность - атомы взаимно располагаются таким образом, чтобы перекрывание валентных орбиталей было максимальным. Расположение в
пространстве общей электронной пары определяется ориентацией
атомных валентных орбиталей
3) Энергия связи определяется только силами электростатического взаимодействия электронов и ядер и зависит от величины перекрывания орбиталей
Из двух связей та прочнее, где перекрывание валентных атомных орбиталей больше
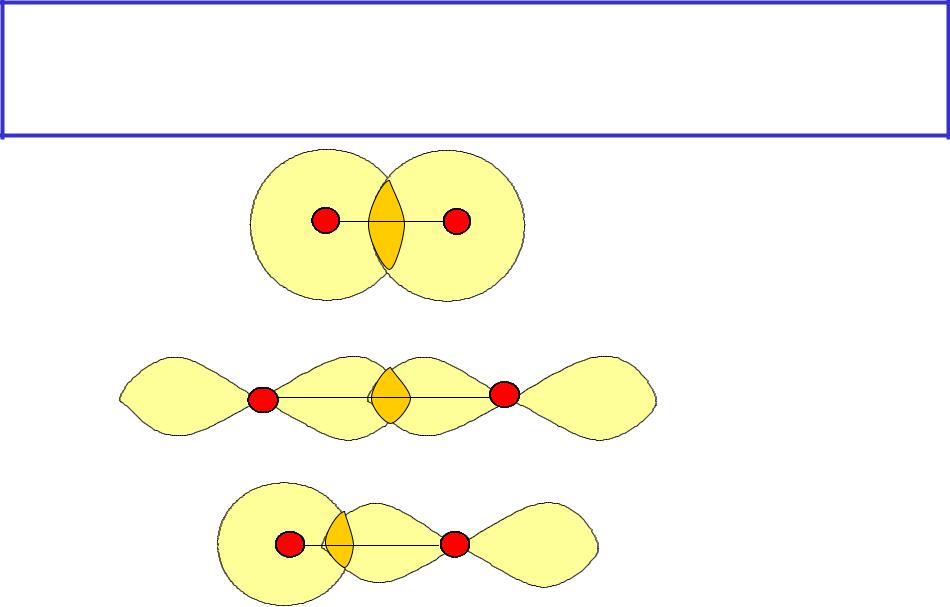
Перекрывание валентных АО по - типу ( -связь) -
цилиндрическая симметрия-свободное вращение атомов относительно линии связи
s-s |
H2 |
(H 1s1) |
px-px |
Cl2 |
|
(Cl 3s23p5) |
||
|
s-p |
HF |
(H1s1; F 2s22p5) |
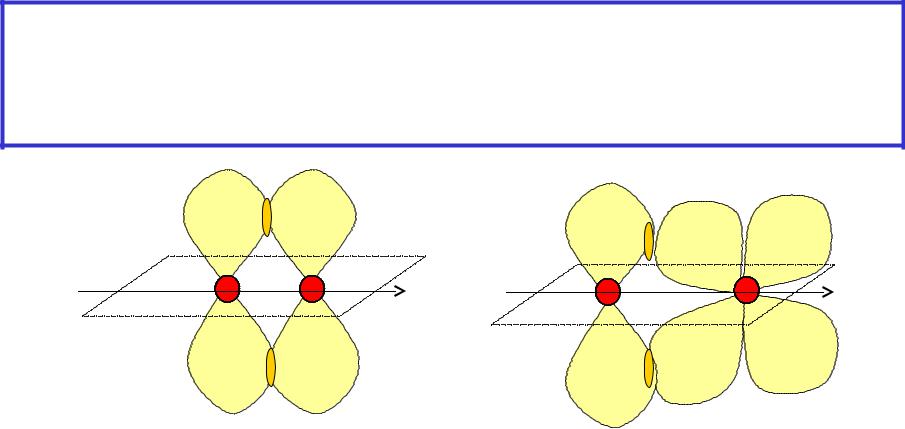
Перекрывание АО по - типу ( -связь) –
вращение индивидуального атома вокруг линии связи исключено(существование цис- и транс-
изомеров)
p-p |
p-d |
( pz-pz; py-py) |
|
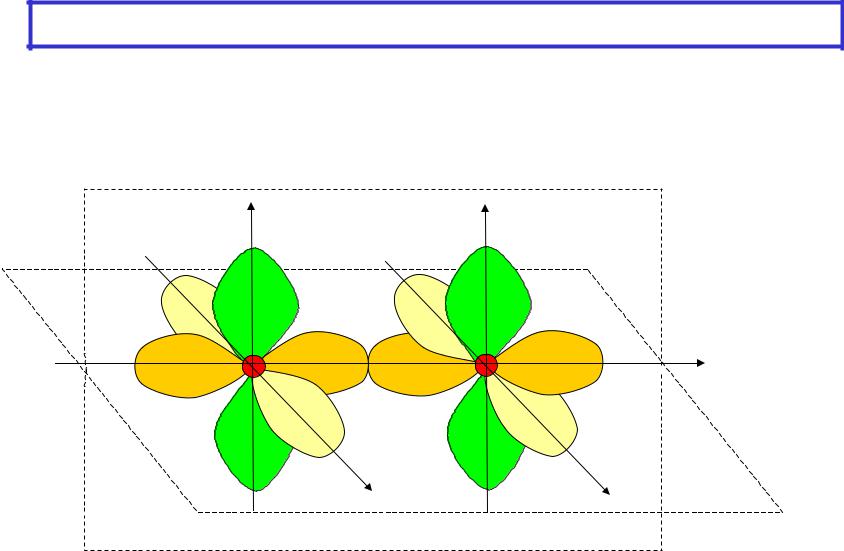
Кратность связи. Схема образования
–двойная связь ( - и одна -связь)
–тройная связь ( - и две -связи)
z |
z |
pz-pz |
|
|
px-px |
|
x |
y |
y |
py-py |

Примеры
Связь |
Кратность |
Энергия, |
Длина, |
|
|
кДж/моль |
Å |
C C |
Простая |
342 |
1,54 |
C=C |
Двойная |
600 |
1,34 |
|
Тройная |
826 |
1,20 |
C C |
|
|
|
F F |
Простая |
155 |
1,42 |
O=O |
Двойная |
494 |
1,21 |
|
Тройная |
942 |
1,10 |
N N |
|
|
|
Cl-Cl |
Простая |
239 |
1,99 |
Br-Br |
Простая |
190 |
2,28 |
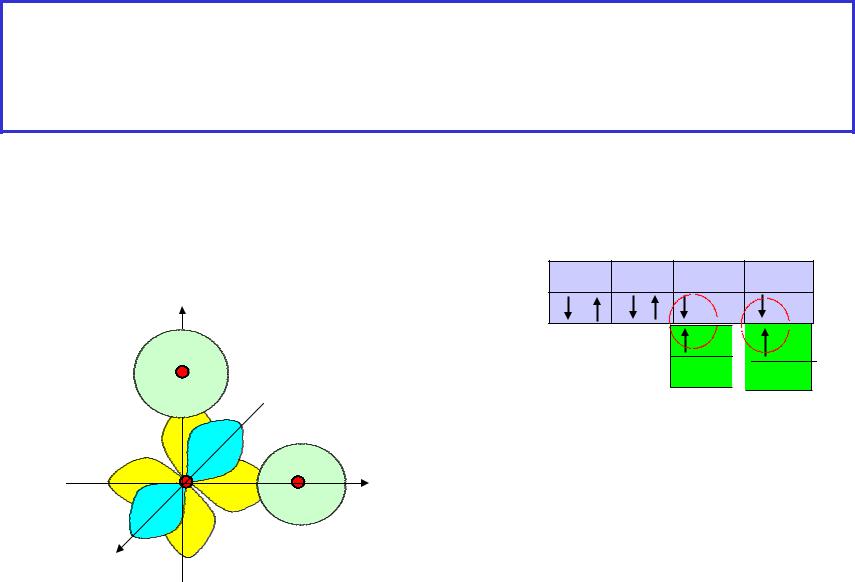
2.5 Геометрия простейших молекул (МВС) – следствие ориентации валентных АО в пространстве.
Недостаточность МВС. Понятие гибридизации АО
Молекулы H2O, H2S, H2Se |
H 1s1 |
||
|
|||
Строение определяется |
O, S, Se |
||
пространственной ориентацией |
|
||
валентных атомных орбиталей - |
О |
||
АО |
z |
s |
|
|
|
|
|
|
|
px |
|
|
|
s |
|
|
|
y |
|
|
x |
|
|
ns2npx2py1pz1
2s2 2px2 2py1 2pz1
1s1 
 1s1
1s1
Н
Н
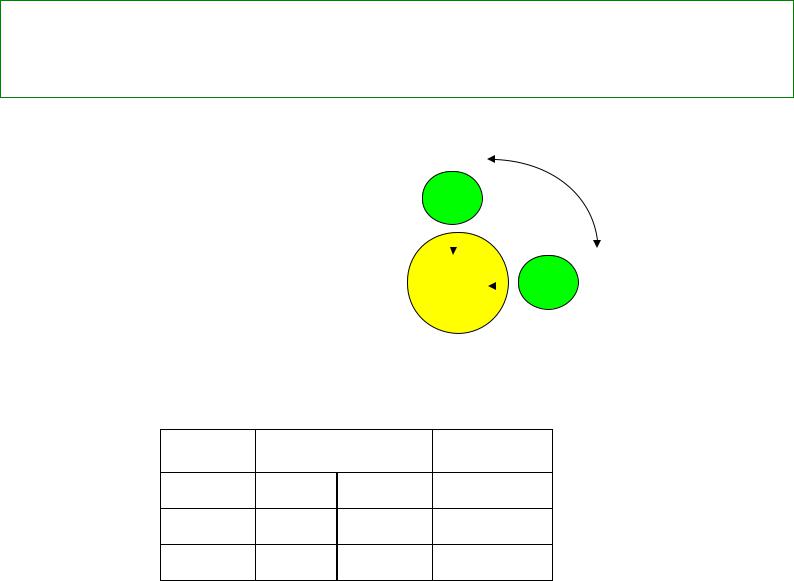
Молекулы H2O, H2S, H2Se и величина валентного угла в зависимости от эффективного заряда δ
Э Н |
Н+ |
|
|
Н-Э-Н 90 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
Н+
|
|
|
|
|
Н |
Э |
Н-Э-Н |
H2O |
2.02 |
3,44 |
104,5о |
H2S |
2.02 |
2,58 |
92,2о |
H2Sе |
2.02 |
2,55 |
91,0о |
Теория гибридизации АО(атомных орбиталей)
Л.Полинг, Дж.Слэтер
Молекула СH4 – все атомы водорода равноценны H 1s1
АО: С 2s22px1py1pz0 |
ГАО: |
С 2s12px1py1pz1 |
|||
|
|
2s1 |
2px1 |
2py1 |
2pz1 |
1s1 |
1s1 |
1s1 |
1s1 |
s- 1 p- 3
Гибридизация орбиталей -замена атомных орбиталей(АО) близких по энергии и различной симметрии таким же числом равноценных гибридных атомных орбиталей (ГАО) при образовании хим.связи
Правила построения ГАО
1 ΨГАО=ΣCiΨАО |
2 Е всех ГАО одинакова, ЕАО ЕГАО |
3 nАО = ΣnГАО |
[ΣnГАО 6 (spd)] |
4 -от вида и числа АО зависит пространств.конфигурация ГАО(форма молекул)
5 - могут гибридизоваться не все валентные электроны (гибридные орбитали образуют -связи, не гибридные - )
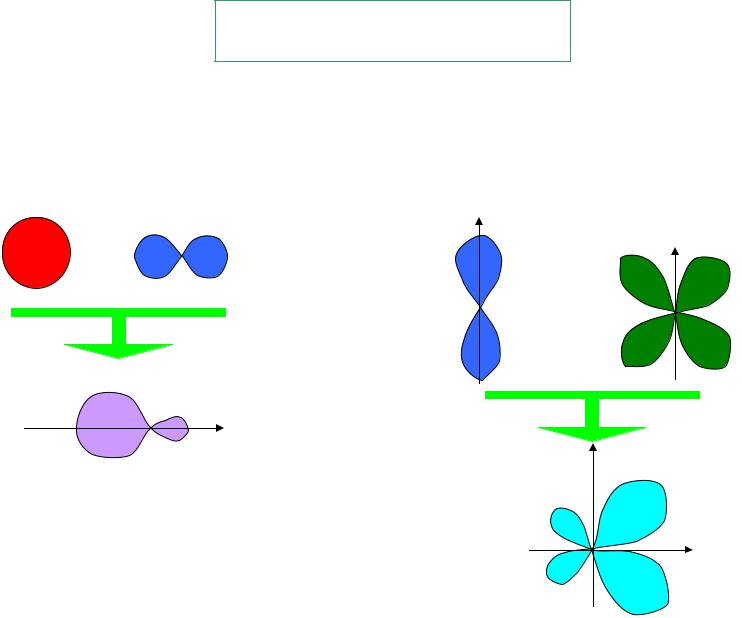
Гибридные орбитали
гао ci ао
s –орбиталь p-орбиталь |
p-орбиталь |
d-орбиталь |
Две sp-гибридных орбитали
Две pd-гибридных орбитали
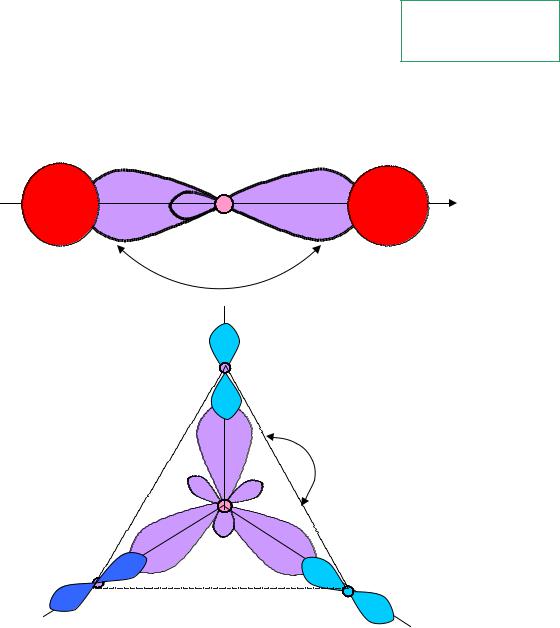
Примеры
sp-гибридизация |
H |
Be |
H |
молекула АВ2 |
|
x |
|
BeH2 (...2s12p1) |
|
|
|
|
180o |
|
|
линия |
|
|
sp2-гибридизация |
F |
|
|
||
молекула АВ3 |
120o |
|
BF (...2s12p2) |
||
B |
||
3 |
||
|
||
плоский треугольник |
|
|
|
F |
