
- •1.Классификация электрохимических методов обработки поверхности металлов, их применение в формном производстве.
- •2.Основные составляющие электрохимических систем: определение понятий, примеры. Особенности номенклатуры электролитов в прикладной электрохимии.
- •3.Возникновение разности потенциалов на границе раздела фаз металл-раствор. Уравнение Нернста. Равновесный потенциал. Стандартный потенциал.
- •4.Какой процесс называют электролизом? Что собой представляют анодные и катодные процессы с точки зрения окислительно-восстановительных реакций? Условия протекания параллельных реакций на электродах.
- •6.Закон Фарадея. Расчет основных технологических параметров(продолжительность процесса ,толщина покрытия ,скорость процесса ,выход по току)для процессов осаждения (растворения )металлов.
- •7.Закон Фарадея. Расчет основных технологических параметров(продолжительность процесса ,толщина покрытия ,скорость процесса ,выход по току)для процессов анодирования.
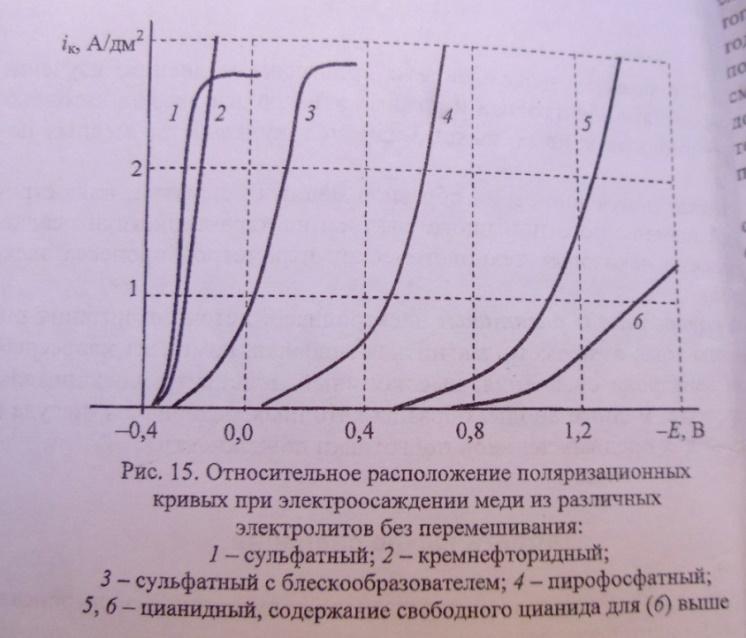
- •8.Поляризационные кривые :виды кривых, способы получения. Поляризуемость электрода. Какие характеристики образующего металлического осадка зависят от поляризации;от поляризуемости электрода?
- •9.Стадийность электрохимического процесса . Понятие о лимитирующей стадии.
- •10.Диффузионная кинетика. Придельный ток диффузии иона. Качество металлических покрытий ,полученных в условиях диффузионных ограничений.
- •15.Блескооброзующие и выравнивающие добавки пав.Диф природа выравнивания. Механизм обр блескообр.
- •16. Первичное и вторичное(действительное) распределение тока. Распределение металла. Факторы, определяющие равномерность распределения тока и металла по поверхности электрода.
- •17. Методы оптимизации первичного распределения тока.
- •18. Рассеивающая способность электролита. Способы её увеличения. Методы измерения рассеивающей способности.
- •19. Обезжиривание. Назначение процесса. Механизм процесса. Химические и электрохимические способы обезжиривания.
- •20. Травление, активация, осветление. Назначение операций, основные реакции. Примеры компонентного состава растворов для травления и активации.
- •21. Особенности подготовки поверхности в гальванопластике. Требования, предъявляемые к токопроводящим и разделительным слоям.
- •22. Электрохимическое осаждение меди. Применение процесса в технологии изготовления печатных форм. Общая характеристика процесса, основные и сопутствующие реакции для электролитов различных типов.
- •23. Закономерности процессов электроосаждения меди в кислых и комплексных электролитах. Принципы построения компонентного состава электролитов. Сравнительная характеристика электролитов.
- •25. Применение процесса никелирования при изготовлении печатных форм. Общая характеристика процесса, основные и сопутствующие реакции.
- •26. Основные электролиты, их сравнительная характеристика. Принципы построения компонентного состава электролитов.
- •27. Чем объясняется существование нижней и верхней границы pH при никелировании? какое влияние оказывают температура и плотность тока на выход по току?
- •28. Анодные процессы никелирования. Влияние условий электроосаждения на твердость и износоустойчивость никелевых осадков.
- •29. Влияние различных факторов на выход по току и качество никелевых покрытий.
- •30. Закономерности процесса электроосаждения хрома. Принципы построения компонентного состава электролитов хромирования. Особенности катодного и анодного процессов.
- •31. Влияние условий электроосаждения на выход по току и свойства хромовых покрытий. От каких параметров процесса зависит равномерность распределения хрома по катодной поверхности? Как ее повысить?
- •32. Особенности анодного процесса при хромировании: материал анода, электродные реакции, соотношение площадей анодной и катодной поверхности.
- •33. Стандартный электролит хромирования. Обоснование состава электролита с анализом катодных поляризационных кривых, получение в растворе CrO3.
- •35. Последовательность технологических операций при изготовлении монометаллических форм офсетной печати на алюминиевой основе, их назначение. Основные реакции.
- •36. Назначение процедуры зернения поверхности. Технологические параметры процесса, их взаимосвязь со структурой поверхности.
- •37. Основные виды электролитов анодирования Al и его сплавов. Механизм роста аноднооксидной пленки в растворах, взаимод-х с окс.
- •38. Механизм процесса анодного оксидирования аллюминия
- •39. Влияние условий электролиза на толщину и пористость окс пленок.
- •40. Методы испытания прочности адгезии покрытия к подложке, измерения толщины, твердости,…
22. Электрохимическое осаждение меди. Применение процесса в технологии изготовления печатных форм. Общая характеристика процесса, основные и сопутствующие реакции для электролитов различных типов.
Медь – это электроположительный металл.
E°Cu2+/Cu = +0,34 В, . E°Cu+/Cu = +0,51 В.
ГОТОВЯТ В ОСНОВНОМ НА CU2+.
НЕ ОБЛАДАЕТ СПОСОБНОСТЬЮ К ПАССИВАЦИИ, ПОЭТОМУ ХОРОШО РАЗРУШАЕТСЯ ПОД ВОЗДЕЙСТВИЕМ АГРЕССИВНЫХ СРЕД КАК В УСЛОВИЯХ АТМОСФЕРНОЙ КОРРОЗИИ, ТАК И В УСЛОВИЯХ ЭКСПЛУАТАЦИИ ЭЛЕМЕНТОВ ПОЛИГРАФ ОБОРУДОВАНИЯ.
ВОСТРЕБОВАННЫЕ ФУНКЦИОНАЛЬНЫЕ СВОЙСТВА:
ПЛАСТИЧНОСТЬ, 2. МЯГКОСТЬ МЕХ ОБРАБОТКИ. 3. ВЫСОКАЯ ОДНОРОДНОСТЬ МИКРОСТРУКТУРЫ.
СЛЕДОВАТЕЛЬНО ШИРОКО ИСПОЛЬЗУЕТСЯ В ИЗГОТОВЛЕНИИ РАЗЛИЧНЫХ КЛИШЕ, ШТАМПАХ, ФОРМ ГЛУБОКОЙ ПЕЧАТИ И Т.Д.
Т.К. МЕДЬ ЛЕГКО ОСАЖДАЕТСЯ ИЗ ПРОСТЫХ ЭЛЕКТРОЛИТОВ И СКОРОСТЬ ОСАЖДЕНИЯ ВОЗРАСТАЕТ, МЕДЬ ИСПОЛЬЗУЕТСЯ И ДЛЯ ГАЛЬВАНОПЛАСТИЧЕСКОГО ИЗГОТОВЛЕНИЯ КОПИЙ ХУДОЖЕСТВЕННЫХ ИЗДЕЛИЙ, ГРАВЮР И Т.Д.
В кислых:
A: Cu – 2e = Cu2+
K: Cu2+ + 2e =Cu
В щелочных:
А: Cu° + 2P2O74- - 2e=[Cu(P2O7)2]6-
К: [Cu(P2O7)2]6- +2e = Cu° + 2P2O74-
23. Закономерности процессов электроосаждения меди в кислых и комплексных электролитах. Принципы построения компонентного состава электролитов. Сравнительная характеристика электролитов.
Электролиты осаждения: 1. Простые( группа кислых) 2. Комплексные (щелочной характер)
Простые - вопрос 24.
Комплексные электролиты осаждения характеризуются: а) повышение рассеивающей способности, б) равномерная микроструктура осадка.
Так как в этих электролитах отсутствует дополнительные блескообразующие и выравнивающие компоненты, можно получать пластичные осадки с низкой пористостью. Однако несмотря на значительное улучшение свойств по сравнению с простыми электролитами, область применения ограничена. Используется электроосаждение меди на электроотрицательных металлах (алюминии, его сплавах, стали, цинка и его сплавов и др)
К компл электролитам относятся пирофосфатные, этилендиаминовые, цианистые.
В состав входят: 1. Соли меди, 2. Избыток соединения, обеспечивающее электролит лигандами ( K4P3O7, C2H4(NH2)2,KCN). 3. Добавки, обеспеч улучшенное растворение анодов (цитраты, трилонаты, оксалаты и др.). 4. Необходимое pH: NaOH,KOH – для пирофосф. , NaOH – для этилендиаминов. 5. Блеск (неорг добавки): Na2Se и др.
В таких электролитах медь связана в соответсвующие комплексы:
К: [Cu(P2O7)2]6- +2e = Cu° + 2P2O74-
[Cu(CN)3]2- +e = Cu° + 3CN-
[Cu(C2H4(NH2)2)]° +2e = Cu° + C2H4(NH2)2°
Т.к. поляризация увеличивается, а ECu смещен в электроотрицательную сторону, выход по току < 100% из-за параллельного протекания реакции выделения водорода
Пирофосфаотные 98-99%, т.к. концентрация катионов меди достаточной высока
Цианитсые 60-70%
Недостаток: многокомпонентные растворы с высокой стоимостью.
24. Кислые электролиты меднения: назначение компонентов, условия осаждения меди. Способы интенсификации процесса при изготовлении цилиндров глубокой печати.
1) соль меди, 2) соответствующая кислота
Чем выше концентрация соли меди, тем выше скорость осаждения покрытий, особенно при введении перемешивания электролита. Это связано с тем, что процесс электроосаждения контролируется диффузией (в области рабочей плотности тока, наблюдается смешанный кинетический контроль реакции: Cu2++2e = Cu°)
1)
CuSO4
* 5H2O
– 350 г/дм3
(макс растворимость) --- 2) H2SO4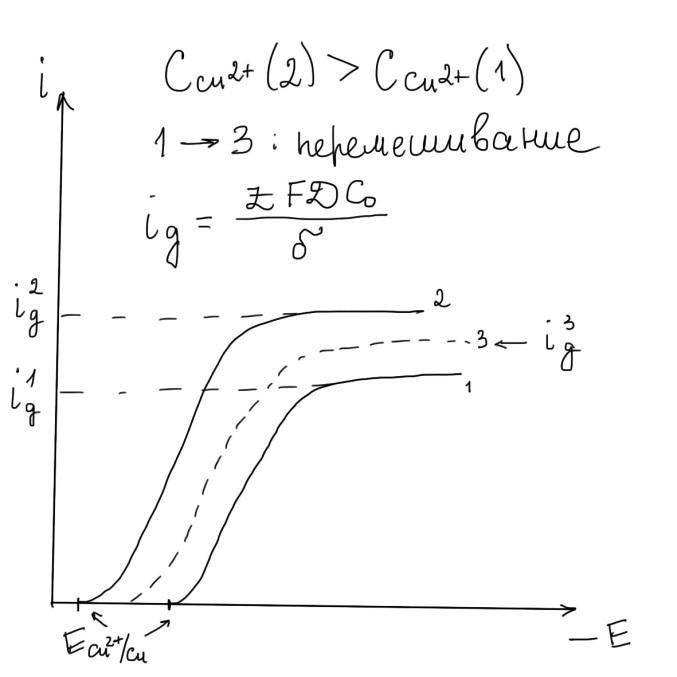
1) Cu(BF4)2 – 480 г/дм3 ---- 2)HBF4 +(H3BO3)
1) CuSiF6 – 500 г/дм3 ----- 2) H2SiF6
С увеличением концентрации соли повышается рабочая плотность тока и толщина осажденного слоя.
Концентрация соли в пределах 60 – 300 г/дм3
Свободная кислота, присутствующая в электролите в значительных количествах, и служит для повышения стабильности электролита. Для сульфатного электролита концентрация кислоты 50-180 г/дм3. Также с увеличением концентрации кислоты повышается катодная поляризация осаждения меди из-за снижения активной концентрации Cu2+ в ДЭС катода и повышается перенапряжение.
Несмотря на значительную концентрацию H+ в растворе меднения выход по току меди почти 100%.
Выход
по току меди отличается от 100% и снижается
с увеличением температуры электролита
и интенсивностью перемешивания его
сжатым воздухом. Это связано с явлением
неполного катодного восстановления
меди и процессом гидролиза раствора. 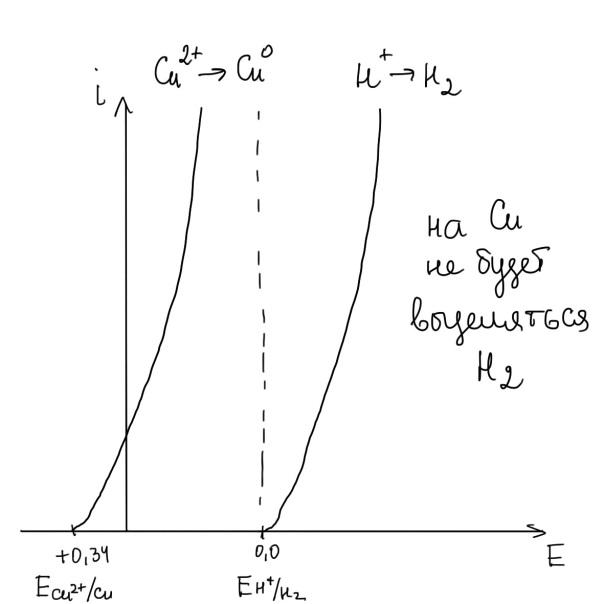
K: Cu2+ +e = Cu+ (лимитирующая стадия) Скрость замедленная
Cu+ +e = Cu° Скорость быстрая
Дополнительное равновесие
Cu2+ + Cu°=2 Cu+ (2) реакция диспропорционирования.
Именно замедленность первой стадии , не успевающей компенсировать расход Cu+ в результате протекания химической и электрохим реакций, приводит к выходу по току меди меньше 100% (первая стадия 95-99, вторая от 70)
Влияние температуры сказывается посредством ускорения явления гидролиза ионов одновалентной меди с выводом их из зоны реакции.
2Cu+ + H2O = Cu2O(осадок) + 2H+
Кроме того Cu+ хорошо расходуется в присутствии ионов водорода.
4Cu+ +O2+ 4H+ =4Cu2+ + 2H2O
Избыток кислоты препятствует протеканию гидролиза ионов Cu+ и приводит к стабилизации состава раствора. Cu2O представляет собой мелкодисперсную взвесь (мех примесь), которая способна сорбироваться на поверхности катодной меди с ухудшением качества.
Осаждение покрытия с ростом скорости применяют электролиты, содержащие:
СuSO4 ----200-300 г/дм 3
H2SO4--- 50-80 г/дм 3
ПР(СuSO4) = СCu2+ * CSO42- ( если концентрация анионов кислоты повышается, то конц катионов меди снижается)
Для получения покрытий с высокой рассеивающей способностью, малыми размерами зерна, чаще применяют расторы:
СuSO4 ----60-90 г/дм 3
H2SO4--- 80-120 г/дм 3
В качестве анодов в таких электролитах применяют металлические медные аноды, содержащие небольшую добавку кислорода, серы и фосфора до 0,01 массового %. Эти добавки обеспечивают равномерное растворение анодов без выкрашивания отдельных зерен. Допустимые анодные плотности тока зависят от концентрации электролита и в разбавленном растовре составляют 5 А/дм2; в концентрированных – 3 А/дм2. Связано с солевой пассивацией анодов. Соотношение Sa:Sk=3:1 и 1:1
В кислых электролитах нет электроосаждения меди на электроотрицательных металлах (контактное вытеснение). Добавки – орг добавки, содержащие аминогруппу, и серосодержащие добавки (мочевина). Уменьшение зерна -> повышение поляризации -> повышение рассеивающей способности
