
- •1.Классификация электрохимических методов обработки поверхности металлов, их применение в формном производстве.
- •2.Основные составляющие электрохимических систем: определение понятий, примеры. Особенности номенклатуры электролитов в прикладной электрохимии.
- •3.Возникновение разности потенциалов на границе раздела фаз металл-раствор. Уравнение Нернста. Равновесный потенциал. Стандартный потенциал.
- •4.Какой процесс называют электролизом? Что собой представляют анодные и катодные процессы с точки зрения окислительно-восстановительных реакций? Условия протекания параллельных реакций на электродах.
- •6.Закон Фарадея. Расчет основных технологических параметров(продолжительность процесса ,толщина покрытия ,скорость процесса ,выход по току)для процессов осаждения (растворения )металлов.
- •7.Закон Фарадея. Расчет основных технологических параметров(продолжительность процесса ,толщина покрытия ,скорость процесса ,выход по току)для процессов анодирования.
- •8.Поляризационные кривые :виды кривых, способы получения. Поляризуемость электрода. Какие характеристики образующего металлического осадка зависят от поляризации;от поляризуемости электрода?
- •9.Стадийность электрохимического процесса . Понятие о лимитирующей стадии.
- •10.Диффузионная кинетика. Придельный ток диффузии иона. Качество металлических покрытий ,полученных в условиях диффузионных ограничений.
- •15.Блескооброзующие и выравнивающие добавки пав.Диф природа выравнивания. Механизм обр блескообр.
- •16. Первичное и вторичное(действительное) распределение тока. Распределение металла. Факторы, определяющие равномерность распределения тока и металла по поверхности электрода.
- •17. Методы оптимизации первичного распределения тока.
- •18. Рассеивающая способность электролита. Способы её увеличения. Методы измерения рассеивающей способности.
- •19. Обезжиривание. Назначение процесса. Механизм процесса. Химические и электрохимические способы обезжиривания.
- •20. Травление, активация, осветление. Назначение операций, основные реакции. Примеры компонентного состава растворов для травления и активации.
- •21. Особенности подготовки поверхности в гальванопластике. Требования, предъявляемые к токопроводящим и разделительным слоям.
- •22. Электрохимическое осаждение меди. Применение процесса в технологии изготовления печатных форм. Общая характеристика процесса, основные и сопутствующие реакции для электролитов различных типов.
- •23. Закономерности процессов электроосаждения меди в кислых и комплексных электролитах. Принципы построения компонентного состава электролитов. Сравнительная характеристика электролитов.
- •25. Применение процесса никелирования при изготовлении печатных форм. Общая характеристика процесса, основные и сопутствующие реакции.
- •26. Основные электролиты, их сравнительная характеристика. Принципы построения компонентного состава электролитов.
- •27. Чем объясняется существование нижней и верхней границы pH при никелировании? какое влияние оказывают температура и плотность тока на выход по току?
- •28. Анодные процессы никелирования. Влияние условий электроосаждения на твердость и износоустойчивость никелевых осадков.
- •29. Влияние различных факторов на выход по току и качество никелевых покрытий.
- •30. Закономерности процесса электроосаждения хрома. Принципы построения компонентного состава электролитов хромирования. Особенности катодного и анодного процессов.
- •31. Влияние условий электроосаждения на выход по току и свойства хромовых покрытий. От каких параметров процесса зависит равномерность распределения хрома по катодной поверхности? Как ее повысить?
- •32. Особенности анодного процесса при хромировании: материал анода, электродные реакции, соотношение площадей анодной и катодной поверхности.
- •33. Стандартный электролит хромирования. Обоснование состава электролита с анализом катодных поляризационных кривых, получение в растворе CrO3.
- •35. Последовательность технологических операций при изготовлении монометаллических форм офсетной печати на алюминиевой основе, их назначение. Основные реакции.
- •36. Назначение процедуры зернения поверхности. Технологические параметры процесса, их взаимосвязь со структурой поверхности.
- •37. Основные виды электролитов анодирования Al и его сплавов. Механизм роста аноднооксидной пленки в растворах, взаимод-х с окс.
- •38. Механизм процесса анодного оксидирования аллюминия
- •39. Влияние условий электролиза на толщину и пористость окс пленок.
- •40. Методы испытания прочности адгезии покрытия к подложке, измерения толщины, твердости,…
1.Классификация электрохимических методов обработки поверхности металлов, их применение в формном производстве.
В ПРОИЗ-ВЕ ПФ НАИБОЛЕЕ ВОСТРЕБОВАНЫ ТЕХНОЛОГИИ ОСНОВАН-Е НА ЯВЛ ЭЛЕКТРОЛИЗА.
1)ЦЕЛЕВОЙ ПРОЦЕСС –ВОССТАНОВЛЕНИЕ МЕ. МЕТОДЫ ПРИМЕНИМЫ ДЛЯ ПОВЕРХНОСТНОЙ МОДИФИКАЦИИ ФИЗ-ХИМ СВОЙСТВ ЭЛЕМЕНТОВ ОБОРУДОВАНИЯ (ГАЛЬВАНОСТЕГИЯ) ЛИБО ДЛЯ ИЗГОТОВЛЕНИЯ ЭЛЕМЕНТОВ ОБОРУДОВАНИЯ(ГАЛЬВАНОПЛАСТИКА).
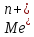 +
ne
→
+
ne
→
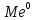
В электролите на поверхности
Ni, Cr, Zn, Cu, Sn, сплавы и т.д.
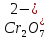 +14
+14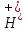 +12e→
2
+12e→
2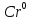 +
7H20
+
7H20
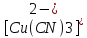 +1e
→
+1e
→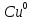 +3
+3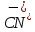
2) АНОДНОЕ ОКСИДИРОВАНИЕ МЕ.
ОБРАБАТЫВАЕМЫЕ ИЗДЕЛИЯ ПОДКЛЮЧАЮТ К + ИСТОЧНИКА ПИТАНИЯ ПОСТОЯННОГО ТОКА И НА ПОВЕРХНОСТИ ИЗДЕЛИЯ ОБРАЗУЕТСЯ ОКСИДНЫЙ СЛОЙ .
2
Ме
+ NН2О
–2ne
→
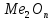 +
2n
+
2n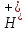
Изделие покрытие
РЕАКЦИЯ
ОКСИДИРОВАНИЯ МЕДИ: Си
+2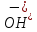 -2е
→ СиО + Н2О
-2е
→ СиО + Н2О
Анодный процесс
Си + 2ОН → Си+ Н2О+ 2е
3)ЭЛЕКТРОХИМ ПОЛИРОВАНИЕ.
АНОДНОЕ РАСТВОРЕНИЕ МИКРОВЫСТУПОВ МЕ ПОВЕРХНОСТИ ПРИВОДЯЩЕЕ К СГЛАЖИВАНИЮ МИКРОЭЛЕМ. ПОЛИРУЕМОГО ИЗДЕЛИЯ. ЗА СЧЕТ СПЕЦИФ СВ-В ЭЛЕКТРОЛИТА АНОДНОЕ ОКИСЛЕНИЕ МЕ СОСРЕДОТАЧИВАЕТСЯ НА МИКРОВЫСТУПАХ ПОВЕРХНОСТИ.
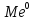 -
nе
→
-
nе
→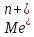
Выступ электролит
ГАЛЬВОНИЧЕСКИЕ ЭЛЕМЕНТЫ ЛЕЖАТ В ОСНОВЕ ПРОЦЕССОВ ТРАВЛЕНИЯ МЕ В ВОДН РА-Х КИСЛОТ ИЛИ ЩЕЛОЧЕЙ . ПРИ ПРОСТРАНСТВЕННОМ РАЗДЕЛЕНИИ ПРОЦЕССОВ ОКИСЛЕНИЯ И ВОССТАНОВЛЕНИЯ РЕАЛИЗУЕТСЯ УДАЛЕНИЕ ЧАСТИ МЕ-КОЙ ПОВЕРХНОСТИ С СОЗДАНИЕМ НЕОБХОДИМОГО РЕЛЬЕФА. ЗОНИРОВАНИЕ ПОВЕРХНОСТИ РЕАЛИЗУЕТСЯ ТРАДИЦИОННЫМИ МЕТОДАМИ ФОТОЛИТОГРАФИИ.
Ме
+ 2Н → Ме +
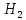
А
Ме
- ne
→
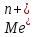
K
2H
+ 2e
→
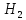
НА ПОВЕРХНОСТИ ОБРАБАТЫВАЕМОГО МЕ ФОРМИРУЕТСЯ ЧЕРЕДУЮЩИЕСЯ МИКРОУЧАСТКИ С РАЗЛИЧНЫМ ПОТЕНЦИАЛОМ.
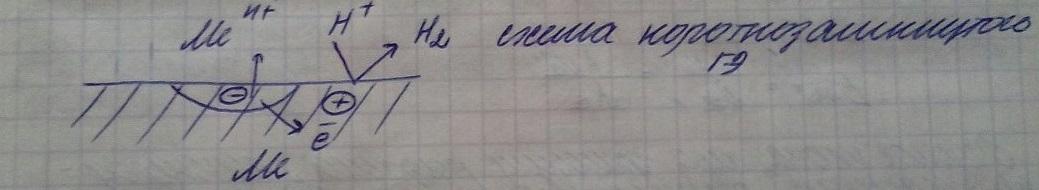
2.Основные составляющие электрохимических систем: определение понятий, примеры. Особенности номенклатуры электролитов в прикладной электрохимии.
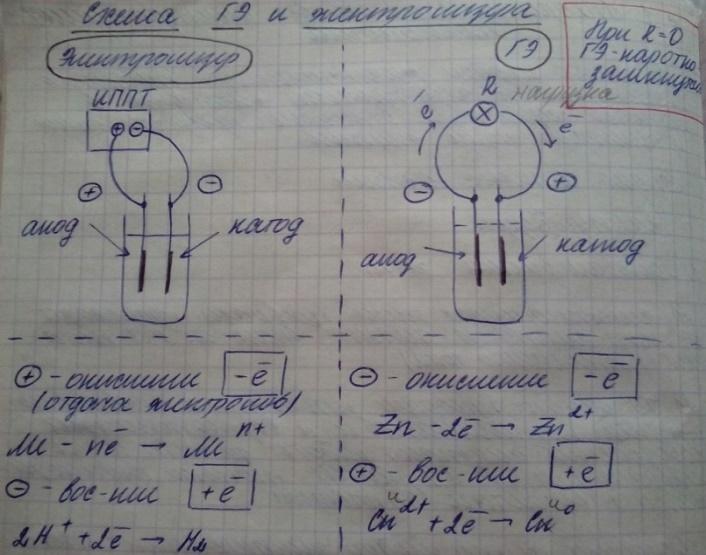
2 ТИПА СИСТЕМ: ЭЛЕКТРОЛИЗЁРЫ, ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ.
В ЭЛЕКТРОЛИЗЁРЕ ХИМИЧЕСКИЕ ПРЕВРАЩЕНИЯ ПРОИСХОДЯТ ЗА СЧЁТ ЭЛЕКТРИЧЕСКОЙ ЭНЕРГИИ ВНЕШНЕГО ИСТОЧНИКА ПИТАНИЯ(ПОСТОЯННОГО ТОКА).
В ГАЛЬВАНИЧЕСКОМ ЭЛЕМЕНТЕ ХИМ ПРЕВРАЩЕНИЯ ПРИВОДЯТ К ПОЯВЛЕНИЮ РАЗНИЦЫ ПОТЕНЦИАЛОВ И К ВОЗМОЖНОСТИ СОВЕРШЕНИЯ ЭЛЕКТРИЧЕСКОЙ РАБОТЫ ЗА СЧЁТ ХИМ ПРЕВРАЩЕНИЙ.
ОСНОВНЫЕ ЭЛЕМЕНТЫ ЛЮБОЙ ЭЛЕКТРОХИМ СИСТЕМЫ:
-ЭЛЕКТРОДЫ( КАК МИН 2)- ЭЛЕКТРОННЫЙ ПРОВОДНИК ЭЛЕКТРИЧЕСТВА ИЛИ ПРОВОДНИК 1 РОДА , НАХОДЯЩИЙСЯ В КОНТАКТЕ С ПРОВОДНИКОМ 2 РОДА(ЭЛЕКТРОЛИТОМ ИЛИ ИОННЫМ ПРОВОДНИКОМ)
-ЭЛЕКТРОЛИТ(ОДИН ИЛИ НЕСКОЛЬКО), КОТОРЫЙ СОДЕРЖИТ РЕАГИРУЮЩИЕ В-ВА И ИОНИЗИРОВАННЫЕ В-ВА, ОБЕСПЕЧИВАЮЩИЕ ЕГО ЭЛЕКТРОПРОВОДНОСТЬ.
- ВНЕШНЯЯ ЦЕПЬ(МЕТАЛЛИЧЕСКИЙ ПРОВОДНИК, СОЕДЕНЯЮЩИЙ ЭЛЕКТРОДЫ И ОБЕСПЕЧИВАЮЩИЙ ПРОХОЖДЕНИЯ ТОКА М-ДУ НИМИ).
3.Возникновение разности потенциалов на границе раздела фаз металл-раствор. Уравнение Нернста. Равновесный потенциал. Стандартный потенциал.
МЕХАНИЗМ
ВОЗНИКНОВЕНИЯ ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА
МОЖНО РАССМОТРЕТЬ НА ПРИМЕРЕ МЕТАЛЛИЧЕСКОЙ
ПЛАСТИНЫ (ЭЛЕКТРОД) , ПОГРУЖЕННЫЙ В
РАСТВОР СОЛИ ТОГО ЖЕ МЕТАЛЛА (ЭЛЕКТРОЛИТ)
. МЕЖДУ ЭЛЕКТРОДОМ И ЭЛЕКТРОЛИТОМ
НАЧИНАЕТСЯ ВЗАИМОДЕЙСТВИЕ , ЗАКЛЮЧАЮЩЕЕСЯ
В ПЕРЕХОДЕ КАТИОНОВ ИЗ МЕТАЛЛА В РАСТВОР
ИЛИ ОБРАТНО. НАПРАВЛЕНИЕ ПЕРЕХОДА
ОПРЕДЕЛЯЕТСЯ СООТНОШЕНИЕМ ЭЛЕКТРОХИМИЧЕСКИХ
ПОТЕНЦИАЛОВ КАТИОНОВ МЕ В УЗЛАХ
КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ МЕ И В РАСТВОРЕ
( В ГИДРАТИРОВАННОМ СОСТОЯНИИ)
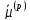 .
.
ЕСЛИ
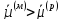 , КАТИОНЫ ПЕРЕХОДЯТ ИЗ МЕТАЛЛА В РАСТВОР
, ПРОТЕКАЕТ РЕАКЦИЯ ОКИСЛЕНИЯ
, КАТИОНЫ ПЕРЕХОДЯТ ИЗ МЕТАЛЛА В РАСТВОР
, ПРОТЕКАЕТ РЕАКЦИЯ ОКИСЛЕНИЯ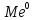 →
→
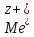 +
+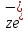 .
ПРИ ЭТОМ ПОВЕРХНОСТЬ МЕ ЗАРЯЖАЕТСЯ
ОТРИЦАТЕЛЬНО , А ПРИЛЕГАЮЩИЙ К НЕЙ СЛОЙ
РА-РА ПРИОБРЕТАЕТ ИЗБЫТОЧНЫЙ ПОЛОЖИТЕЛЬНЫЙ
ЗАРЯД. ЕСЛИ
.
ПРИ ЭТОМ ПОВЕРХНОСТЬ МЕ ЗАРЯЖАЕТСЯ
ОТРИЦАТЕЛЬНО , А ПРИЛЕГАЮЩИЙ К НЕЙ СЛОЙ
РА-РА ПРИОБРЕТАЕТ ИЗБЫТОЧНЫЙ ПОЛОЖИТЕЛЬНЫЙ
ЗАРЯД. ЕСЛИ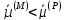 ,
КАТИОНЫ ПЕРЕХОДЯТ ИЗ РАСТВОРА НА МЕТАЛЛ,
ПРОТЕКАЕТ РЕАКЦИЯ ВОССТАНОВЛЕНИЯ ИЛИ
КАТОДНАЯ ПОЛУРЕАКЦИЯ
,
КАТИОНЫ ПЕРЕХОДЯТ ИЗ РАСТВОРА НА МЕТАЛЛ,
ПРОТЕКАЕТ РЕАКЦИЯ ВОССТАНОВЛЕНИЯ ИЛИ
КАТОДНАЯ ПОЛУРЕАКЦИЯ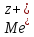 +
+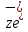 →
→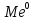 .
.
ПРИ ЭТО ПОВЕРХНОСТЬ Ме ЗАРЯЖАЕТСЯ ПОЛОЖИТЕЛЬНО, РА-Р ПОЛУЧАЕТ ОТРИЦАТЕЛЬНЫЙ ЗАРЯД.
ПОСТЕПЕННО
НАКОПЛЕНИЕ ЗАРЯДОВ НА ГРАНИЦЕ РАЗДЕЛА
ПРИВОДИТ К ВЫРАВНИВАНИЮ ЭЛЕКТРОХИМИЧЕСКИХ
ПОТЕНЦИАЛОВ И УСТАНОВЛЕНИЮ ДИНАМИЧЕСКОГО
РАВНОВЕСИЯ , ПРИ КОТОРОМ ПРЯМОЙ ПЕРЕХОД
КАТИОНОВ, НАПРИМЕР, ИЗ РА-РА НА МЕ
ПРОДОЛЖАЕТСЯ, ОДНОВРЕМЕННО С ТОЙ ЖЕ
СКОРОСТЬЮ ПРОИСХОДИТ ОБРАТНЫЙ ПЕРЕХОД
( из Ме в ра-р):
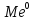 ↔
↔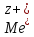 +
+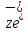 .
ТАКОЕ СОСТОЯНИЕ НАЗЫВАЕТСЯ СОСТОЯНИЕМ
ЭЛЕКТРОХИМИЧЕСКОГО РАВНОВЕСИЯ.
.
ТАКОЕ СОСТОЯНИЕ НАЗЫВАЕТСЯ СОСТОЯНИЕМ
ЭЛЕКТРОХИМИЧЕСКОГО РАВНОВЕСИЯ.
ЗАРЯЖЕННАЯ ПОВЕРХНОСТЬ МЕ ПРИТЯГИВАЕТИЗ РА-РА ИОНЫ ПРОТИВОПОЛОЖНОГО ЗНАКА И ОТТАЛКИВАЕТ ОДНОИМЕННО ЗАРЯЖЕННЫЕ ИОНЫ. Т.О. В ПРИЛЕГАЮЩЕМ К ЭЛЕКТРОДУ СЛОЕ РА-РА ПОЯВЛЯЕТСЯ ИЗБЫТОК ИОНОВ СО ЗНАКОМ, ПРОТИВОПОЛОЖНЫМ ЗНАКУ ЗАРЯДА МЕ. ЭТОТ СЛОЙ ВМЕСТЕ С ЗАРЯЖЕННОЙ ПОВЕРХНОСТЬЮ МЕ ОБРАЗУЕТ НА ГРАНИЦЕ РАЗДЕЛА ФАЗ ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ. МЕЖДУ РАЗНОИМЕННЫМИ ЗАРЯЖЕННЫМИ ОБКЛАДКАМИ ДВОЙНОГО СЛОЯ ВОЗНИКАЕТ РАЗНОСТЬ ПОТЕНЦИАЛОЙ, ОПРЕДЕЛЯЮЩАЯ ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ.
ЛЮБУЮ
ЭЛЕКТРОДНУЮ РЕАКЦИЮ МОЖНО ПРЕДСТАВИТЬ
СЛЕД ОБРАЗОМ: Ох +
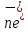 ↔Red
, Ох- ПРОДУКТЫ ПОЛУРЕАКЦИИ ОКИСЛЕНИЯ ,
RED-
ПРОДУКТЫ ПОЛУРЕАКЦИИ ВОССТАНОВЛЕНИЯ.
↔Red
, Ох- ПРОДУКТЫ ПОЛУРЕАКЦИИ ОКИСЛЕНИЯ ,
RED-
ПРОДУКТЫ ПОЛУРЕАКЦИИ ВОССТАНОВЛЕНИЯ.
ВЕЛИЧИНА РАВНОВЕСНОГО ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА ЗАВИСИТ ОТ ПРИРОДЫ И АКТИВНОСТИ КОМПОНЕНТОВ
ЭЛ-ТА, МАТЕРИАЛА ЭЛЕКТРОДА , ТЕМПЕРАТУРЫ И МОЖЕТ БЫТЬ РАССЧИТАНА ПО УРАВНЕНИЮ НЕРНСТА:
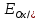 =
=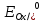 +
+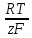 ln
ln
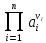
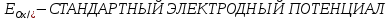 ,
Т.Е. РАВНОВЕРСНЫЙ ПОТЕНЦИАЛ В УСЛОВИЯХ
РАВЕНСТВА ЕДЕНИЦЕ ПРОИЗВЕДЕНИЯ
АКТИВНОСТЕЙ ВЕ-В, УЧАСТВУЮЩИЙ В ЭЛЕКТРОДНОЙ
РЕАКЦИИ, В.
,
Т.Е. РАВНОВЕРСНЫЙ ПОТЕНЦИАЛ В УСЛОВИЯХ
РАВЕНСТВА ЕДЕНИЦЕ ПРОИЗВЕДЕНИЯ
АКТИВНОСТЕЙ ВЕ-В, УЧАСТВУЮЩИЙ В ЭЛЕКТРОДНОЙ
РЕАКЦИИ, В.
R- УНИВЕРСАЛЬНАЯ ГАЗОВАЯ ПОСТОЯННАЯ , РАВНАЯ 8,318ДЖ/(МОЛЬ*К)
Т- ТЕМПЕРАТУРА,К
z- ЧИСЛО ЭЛЕКТРОНОВ, МОЛЬ
F-ПОСТОЯННАЯ ФАРАДЕЯ, РАВНАЯ 96 500 КЛ/МОЛЬ
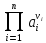 -
ПРОИЗВЕДЕНИЕ АКТИВНОСТЕЙ А ВЕ-В –
УЧАСТНИКОВ ПОЛУРЕАКЦИИ В СТЕПЕНЯХ ,
СООТВЕТСЬВУЮЩИХ ИХ СТЕХИОМЕТРИЧЕСКИМ
КОЭФФИЦИЕНТАМ V,
ПРИЧЁМ
-
ПРОИЗВЕДЕНИЕ АКТИВНОСТЕЙ А ВЕ-В –
УЧАСТНИКОВ ПОЛУРЕАКЦИИ В СТЕПЕНЯХ ,
СООТВЕТСЬВУЮЩИХ ИХ СТЕХИОМЕТРИЧЕСКИМ
КОЭФФИЦИЕНТАМ V,
ПРИЧЁМ
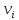 >1
ДЛЯ ОКИСЛЕННОЙ ФОРМЫ ,
>1
ДЛЯ ОКИСЛЕННОЙ ФОРМЫ ,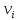 <1
ДЛЯ ВОССТАНОВЛЕННОЙ ФОРМЫ.
<1
ДЛЯ ВОССТАНОВЛЕННОЙ ФОРМЫ.
