
Углеводы
Этот класс природных соединений носит такое название потому, что первым изучен-ным его представителям соответствовала общая формула Cn(H2O)m, то есть формально их можно было рассматривать как гидраты углерода. Позже были найдены близкие по свойствам и по роли в живой природе соединения, которые сейчас также относятся к углеводам, но такой простой общей формуле уже не соответствуют – это аминосахара и ациламиносахара, дезоксисахара и продукты окисления сахаров, соединения более сложного строения, у которых, например, гидроксигруппы этерифицированы остат-ками фосфорной или серной кислоты и другие. В живых клетках углеводы выполняют важные функции: полисахариды используются клетками в качестве источников сво-бодной химической энергии, они являются структурными элементами растительных и животных клеток, углеводы участвуют в построении более сложных молекул – различ-ных гликозидов, гликопротеидов, протеогликанов, гликолипидов, в том числе анти-генных ганглиозидов, нуклеиновых кислот, – из углеводов образуется витамин С, фактор роста бактерий инозит и так называемые заменимые белковые аминокислоты. Важнейшую функцию выполняют углеводы в биоэнергетических процессах, поставляя клеткам энергию, как в анаэробных, так и в окислительных превращениях, и поэтому поликонденсаты самого распространенного углевода глюкозы (крахмал, гликоген) используются всеми видами живого как запас легко мобилизуемой энергии и стро-ительного материала для других молекул. Углеводные фрагменты входят в состав мно-гих биокатализаторов. С участием сахара с пятью атомами углерода - рибозы, постро-ены молекулы рибонуклеиновых кислот, а дезоксирибоза входит в состав вещества наследственности – дезоксирибонуклеиновой кислоты. Гликопротеиды (белки с угле-водными составляющими) обеспечивают смазку в суставах и покрывают стенки крове-носных сосудов. В заключение можно сказать, что основная масса органических соеди-нений на Земле представлена углеводами.
Строение углеводов
Кристаллические, растворимые в воде и имеющие чаще всего сладкий вкус низкомоле-кулярные углеводы называют сахарами. Высокомолекулярные углеводы в воде нерас-творимы. Химическое строение сахаров изучалось многими исследователями прош-лого века, но наибольший вклад в эту область химии внес Э.Фишер. Им, в частности, была разработана методика установления пространственного строения этих соедине-ний, так как уже из брутто-формул простейших сахаров следовало, что они могут содержать только гидроксильные и карбонильные функциональные группы (Байер). Приведенная выше общая формула углеводов для моносахаридов, содержащих одну неразветвленную и неразделенную гетероатомами цепочку атомов углерода (их назы-вают моносахаридами) может быть уточнена, так как моносахариды с n 9 неус-тойчивы и сами разлагаются на более короткие фрагменты по реакции обратной реак-ции альдольной конденсации, гликолевый альдегид HOCH2CHO с брутто-формулой C2H4O2 не имеет асимметрического атома углерода и к углеводам не относится. Точно также в последние годы перестали относить к углеводам глицериновый альдегид и диоксиацетон (n = 3) поскольку у диоксиацетона также нет асимметрического центра и, кроме того, эти соединения не образуют циклических внутренних полуацеталей, которые определяют биохимическую специфику углеводов.
Тем не менее, асимметрический атом углерода глицеринового альдегида, из которого могут быть получены все другие сахара, используется в качестве отправной точки при установлении пространственной конфигурации всех моносахаридов. В проекциях Э.Фишера молекулы сахаров изображают на плоскости с гидроксильными группами справа или слева от центрального атома углерода. Э.Фишер также предложил считать, что у левовращающего глицеринового альдегида при его расположении карбонильной группой вверх гидроксильная группа направлена влево:

L-(-)-Глицериновый D-(+)-Глицериновый Диоксиацетон
альдегид альдегид
В более сложных сахарах с несколькими асимметрическими атомами углерода обо-значение L или D не говорит о направлении вращения плоскости поляризованного света их растворами, а только об абсолютной конфигурации наиболее удаленного от карбонильной группы асимметрического атома углерода с гидроксильной группой. Если в названии сахара надо отразить и показатель оптической активности, то его дополняют значками (-) для левовращающих и (+) для правовращающих соединений. Оказалось, что практически все природные сахара могут быть получены из D-глицери-нового альдегида и поэтому они относятся к D-ряду. Реакции наращивания цепи, начи-нающиеся с альдегидной группы этого соединения, не затрагивают асимметрического атома углерода глицеринового альдегида, поэтому и было принято брать за основу систематизации конфигурацию у наиболее удаленного от карбонильной группы атома углерода. Нумерация атомов углерода у сахаров начинается с альдегидной функции у альдоз или с наиболее близкого к карбонильному углероду концевого атома у кетоз, а в проекциях Фишера формулы сахаров всегда изображаются так, чтобы первый атом углерода был вверху. Тогда генеалогическое дерево моносахаридов будет выглядеть следующим образом:
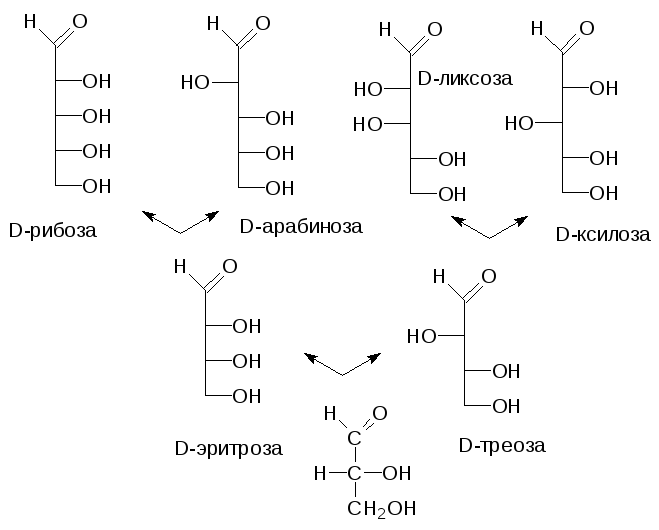
Наиболее распространенные природные гексозы в таком упрощенном варианте представления формул выглядят следующим образом:
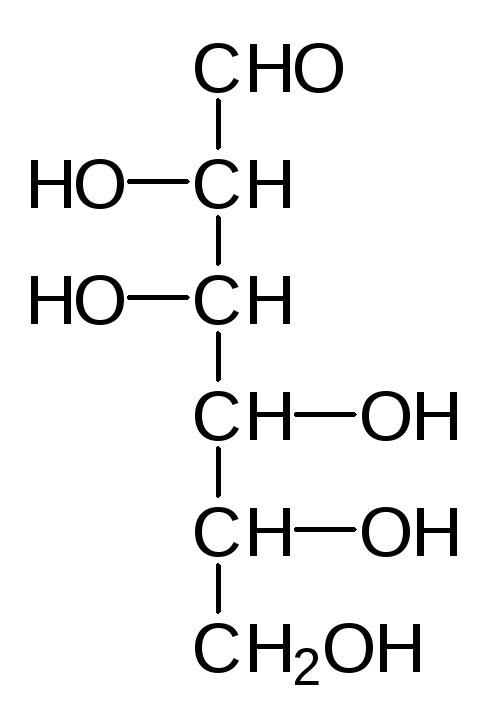
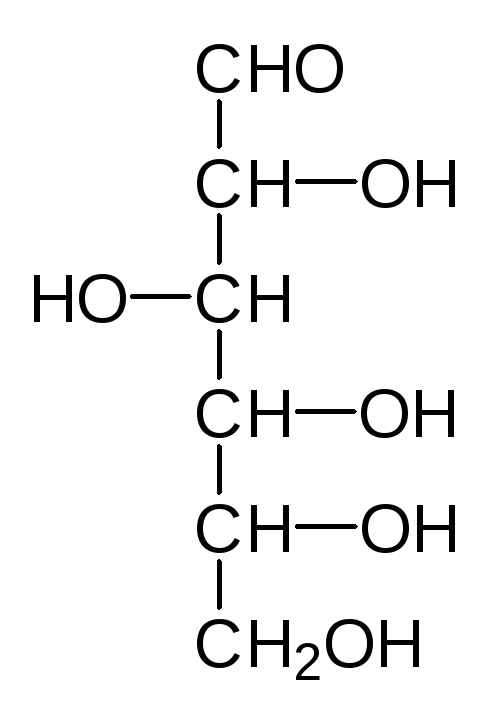


D-Манноза D-Глюкоза D-Фруктоза D-Галактоза
