
- •Метаболизм
- •Обратная связь за счет участия в цепи превращений аллостерического (регулятор-ного) фермента.
- •У высших организмов регуляция метаболических превращений осуществляется гормонами.
- •Третий механизм регуляции метаболизма основан на изменении концентрации ферментов в зависимости от потребности в обеспечиваемых ими превращениях.
- •Катаболические превращения
-
Третий механизм регуляции метаболизма основан на изменении концентрации ферментов в зависимости от потребности в обеспечиваемых ими превращениях.
Это значит, что ферменты, для которых отсутствует субстрат, перестают произво-диться рибосомами, но при росте потребности в этих ферментах снова активируется соответствующий генный участок ДНК (вообще-то и этот процесс основан на гормо-нальной регуляции), снова образуется м-РНК и синтез фермента по этой матрице возоб-новляется. В качестве примера здесь можно привести изменение в балансе питания. При недостаточном поступлении углеводов с пищей интенсифицируется глюконео-генез – длинная цепь превращений образующихся из аминокислот трехуглеродных фрагментов, завершающаяся образованием глюкозы, о чем говорилось выше. При нор-мальном балансе веществ в пище этот механизм не реализуется, но при недостатке глюкозы в пище начинается контролируемый гормонами биосинтез комплекса фер-ментов, отвечающих за глюконеогенез, и потребности организма в глюкозе начинают покрываться за счет образования ее из глюкогенных аминокислот, поступающих с пищей, или при недостатке их в пище из гидролизующихся сократительных белков.
Катаболические превращения
Самым древним метаболическим процессом можно считать гликолиз, заключающийся в получении энергии за счет расщеплении сахаров до меньших молекул без участия кислорода. Процесс гликолиза характерен для всего живого и отдельные его элементы, различающиеся механизмами регуляции и скоростью, присутствуют в любой живой клетке.
Центральный метаболический путь гликолиза завершается образованием из глюкозы двух молекул пировиноградной кислоты (пирувата). У аэробных клеток пируват под-вергается окислительному декарбоксилированию с образованием ацетатного фрагмен-та, а при отсутствии кислорода пировиноградная кислота (пируват) восстанавливается до молочной кислоты (лактат) или же предварительно декарбоксилировавшись превра-щается в спирт (в дрожжевых клетках при отсутствии кислорода).
Расщепление молекулы глюкозы на две молекулы молочной кислоты сопровождается образованием двух молекул АТФ:
![]()
Если рассчитать изменение свободной энергии в этой системе, то окажется, что пре-вращение глюкозы в лактат сопровождается выделением около 47 ккал/моль, а образо-вание двух молекул АТФ требует затрат энергии около 29 ккал/моль. Экзотермический результат равный 18 ккал/моль делает этот процесс необратимым.
Гликолиз начинается с фосфорилирования глюкозы аденозинтрифосфатом (АТР) при катализе АТР-гексозо-6-фосфаттрансферазой (гексокиназой):

Если в этот катаболический процесс включается гликоген (крахмал), то образование 6‑фосфоглюкозы начинается с отщепления гексозного остатка действием фосфорной кислоты. По аналогии с гидролизом такую реакцию называют ацидолизом (в данном конкретном случае фосфоролизом, фермент фосфорилаза):

В обратном направлении эта реакция идет при синтезе гликогена из глюкозы. Образо-вавшаяся 1-фосфоглюкоза изомеризуется в 6-фосфоглюкозу в присутствии фосфоглю-комутазы:

Затем фермент глюкозофосфатизомераза вызывает превращение 6-фосфоглюкозы в 6‑фосфофруктозу:

Далее АТР с участием фосфофруктокиназы снова фосфорилирует 6-фосфофруктозу с образованием 1,6-дифосфофруктозы:

Исходный продукт гликолитического процесса, превратившийся в дифосфорилирован-ную фруктозу, может разложиться на два трехуглеродных карбонильных соединения – фосфат глицеринового альдегида и фосфат диоксиацетона – в результате реализации обратного хода реакции альдольной конденсации:

Это превращение осуществляется при катализе фруктозобисфосфатальдолазой, относя-щейся к лиазам.
В дальнейшие превращения включается только фосфат глицеринового альдегида, но фосфат диоксиацетона может превращаться в фосфат глицеринового альдегида в при-сутствии триозофосфатизомеразы.
Глицеральдегидфосфатдегидрогеназа окисляет фосфат глицеринового альдегида в фос-фат глицериновой кислоты. Катализируемый этим ферментом процесс состоит из ряда превращений. Сначала фосфат глицеринового альдегида присоединяется альдегидной группой к находящейся в активном центре фермента сульфгидрильной группе (из цистеина) с образованием полутиоацеталя.

Далее идет реакция дегидрирования с участием NAD+, а регенерация свободного фер-мента происходит за счет реакции ацидолиза: образовавшийся тиоэфир расщепляется фосфорной кислотой с образованием смешанного ангидрида фосфорной и фосфогли-цериновой кислоты:
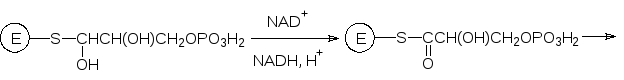

Макроэргическая ангидридная связь в этом соединении переносится на АDP (фосфо-глицераткиназа) и в результате из молекулы фосфоглицеринового альдегида образуется фосфоглицерат, восстановительный потенциал (NADH + H+) и молекула АТР.

Теперь фосфоглицератмутаза (изомераза) переносит фосфатную группу на соседний гидроксил
 ,
,
а фермент енолаза (отщепление воды, лиаза) превращает это вещество в фосфат еноль-ной формы пировиноградной кислоты (фосфоенолпируват):

На следующей стадии пируваткиназа переносит макроэргическую связь фосфата (около 62 кДж/моль) с енольной формы пировиноградной кислоты на АDP с образованием пировиноградной кислоты и АТР:

В анаэробных условиях и при недостатке в клетках кислорода пировиноградная кис-лота гидрируется восстановительным потенциалом, образовавшимся на стадии пре-вращения фосфата глицеринового альдегида в фосфат глицериновой кислоты, и конеч-ным продуктом процесса гликолиза становится молочная кислота:

Осуществляющий это превращение фермент лактатдегидрогеназа назван по обратной реакции превращения лактата в пируват. Таким образом обеспечивают себя энергией разные молочнокислые бактерии и мышцы животных при недостатке кислорода. Отло-жения молочной кислоты в нетренированных мышцах вызывают известные всем боле-вые ощущения на следующий после интенсивной нагрузки день.
Энергетический выход гликолитического превращения глюкозы невелик: из одной мо-лекулы глюкозы получается две молекулы АТР, если же процесс начинался с концево-го глюкозидного остатка гликогена или крахмала, то энергетический выход увеличится в полтора раза (до трех молекул АТР). Правда, эта, казалось бы дополнительная, моле-кула АТР была затрачена на образование расщепляемой фосфорной кислотой глюко-зидной связи, то есть истинный энергетический выход все равно составляют две мо-лекулы АТР.
Не увеличивается выход АТР и в процессе брожения. В дрожжевых клетках при отсут-ствии кислорода воздуха (они факультативные анаэробы) образовавшаяся в ходе глико-лиза пировиноградная кислота подвергается декарбоксилированию до уксусного альде-гида и только после этого в процесс включается NADH и образуется этиловый спирт. Декарбоксилирование пирувата идет на ферментах, в работе которых принимает учас-тие тиаминпирофосфат:

Карбонильная группа пировиноградной кислоты присоединяется по тиазольному циклу тиаминпирофосфата (ТРР), а образовавшийся аддукт декарбоксилируется и разлагается на тиаминпирофосфат и ацетальдегид:

Далее образовавшийся на стадии дегидрирования глицеральдегидфосфата NADH вос-станавливает ацетальдегид до этилового спирта.
В аэробных условиях превращение пирувата идет на пируватдегидрогеназном мульти-ферментном комплексе, работу которого обеспечивают три фермента: пируватдегидро-геназа, дигидролипоил-ацетилтрансфераза и дигидролипоилдегидрогеназа, объединен-ные в частицы диаметром около 45 нм. Комплекс включает пять коферментов или простетических групп (тиаминпирофосфат, липоевая кислота, кофермент А, флавин-адениндинуклеотид и никотинамидадениндинуклеотид). Из них только липоевая кисло-та образуется в организме животных из обычных метаболитов, тогда как тиамин (в ТРР), рибофлавин (в FAD), пантотеновая кислота (в коферменте А) и никотинамид (в NAD+) в должны поступать в организм животных в виде витаминов.
Если гликолиз протекает в цитозоле клетки, то основные аэробные биоэнергетические процессы идут в матриксе митохондрий, отделенном от цитозоля двумя мембранами. Через внешнюю мембрану митохондрий легко проходят все вещества с молекулярной массой до 10000 Дальтонов, а для транспорта через внутреннюю мембрану существуют транспортные системы, одна из которых предназначена для прохода молекул пирови-ноградной кислоты.
Окислительное декарбоксилирование пирувата начинается с присоединения его к ти-аминпирофосфату так, как это было представлено выше для процесса спиртового бро-жения, но образовавшаяся после декарбоксилирования пирувата 1‑гидроксиэтильная группа не отщепляется в виде альдегида, а переносится на один из атомов серы дитио-ланового цикла остатка липоевой кислоты (простетическая группа) в виде ацетата и атома водорода. Остаток липоевой кислоты присоединен к ферменту через аминогруп-пу лизинового фрагмента белковой молекулы:
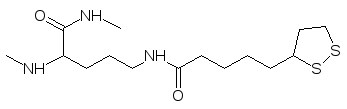
Декарбоксилированный тиамином остаток пировиноградной кислоты переносится на дитиолановый фрагмент по схеме:

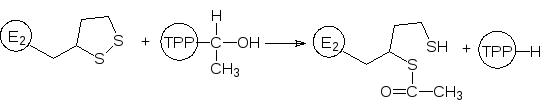
Теперь ацетилированный фрагмент дигидролипоил-ацетилтрансферазы маятниковым движением отходит от тиаминпирофосфатного участка мультиферментного комплекса и отдает ацетильный остаток коферменту А:

Движение деацетилированного остатка дигидролипоевой кислоты завершается у дегид-рогеназного участка мультиферментного комплекса, где атомы водорода двух сульф-гидрильных групп отходят к флавинадениндинуклеотиду и далее к никотинамидаде-ниндинуклеотиду
 ,
,
а дегидрированный остаток с дитиолановым циклом снова возвращается к тиаминпиро-фосфатному участку для того, чтобы снова принять 1-гидроксиэтильный остаток в виде ацетильной группы и атома водорода.
Процесс превращения пировиноградной кислоты в ацетилкофермент А необратим. При введении в обмен веществ меченного по углероду угольного ангидрида радиоактивная метка никогда не обнаруживается в пировиноградной кислоте.
Цикл Кребса
Цикл превращения ацетильного остатка, образовавшегося после декарбоксилирования пирувата, был открыт в 1937 году немецким биохимиком Кребсом, эмигрировавшим в 1933 году в Великобританию. Чаще всего это многостадийное циклическое превраще-ние называют по имени открывшего его ученого, но можно также встретить такие наз-вания, как цикл лимонной кислоты или цикл трикарбоновых кислот. Открытие цикла Кребса было отмечено Нобелевской премией 1953 года. Кребс разделил ее с Липман-ном, открывшим аденозинтрифосфатный цикл.
В основу расшифровки этих биохимических превращений легли наблюдения за обмен-ными процессами в мышечных тканях. В них и раньше обнаруживали незначительные количества дикарбоновых кислот (янтарной, фумаровой, яблочной, щавелевоуксусной), а также трикарбоновых кислот (лимонной, цис-аконитовой, изолимонной). Добавки этих кислот к измельченной мышечной ткани вызывали заметное увеличение потребле-ния ими кислотрода, а малоновая кислота останавливала течение аэробных обменных процессов, вызывая в клетках накопление лимонной, кетоглутаровой и янтарной кис-лот. Кребс установил также, что инкубация мышечных клеток с пировиноградной и щавелевоуксусной кислотой приводит к росту концентрации в них лимонной кислоты. Эти наблюдения легли в основу представлений о циклическом пути превращений, в ходе которого на начальном этапе из оксалоацетата и ацетилкофермента А образуется лимонная кислота, а конечным продуктом является оксалоацетат.
На первой стадии цикла Кребса фермент цитратсинтаза катализирует образование лимонной кислоты (анион цитрат) по схеме:

В учебниках по биохимии принято представлять и назвать кислоты как анионы, акцен-тируя этим внимание на то, что в живых клетках поддерживается слабо щелочная сре-да, но для лучшего понимания химизма процессов здесь и далее будут использоваться традиционные для химиков уравнения реакций. Суть процесса состоит в том, что в тио-эфирах карбоновых кислот атомы водорода в -положении к карбонильной группе по реакционной способности соответствуют аналогичным атомам водорода в карбониль-ных соединениях. В соответствии с этим реакция образования лимонной кислоты по-добна реакции альдольной конденсации, первичным продуктом которой является цитроил-кофермент А, но скорость его гидролиза выше скорости образования и поэто-му обнаружить его в клетках не удается.
Далее лимонная кислота при катализе цис-аконитазой превращается в изолимонную кислоту в результате обратимого отщепления и присоединения молекулы воды с обра-зованием в качестве промежуточного продукта цис-аконитовой кислоты:

Аконитаза – это металлопротеин с атомом железа Fe2+ в активном центре. Превращение цис-аконитовой кислоты в изолимонную идет против правила Марковникова и, дейст-вительно, в равновесном состоянии концентрация лимонной кислоты примерно на порядок превышает концентрацию изолимонной, но в дальнейшем превращении участ-вует только изолимонная кислота, а условия равновесия восполняют ее расход за счет лимонной кислоты.
При дегидрировании цис-аконитовой кислоты образуется трикарбоновая кетокислота, которая сразу декарбоксилируется и превращается в кетоглутаровую кислоту:

Далее ферментная система, аналогичная пируватдегидрогеназному мультиферментно-му комплексу, превращает кетоглутаровую кислоту в сукцинил-кофермент А:

Тиоэфирная связь в этом соединении делает его макроэргическим, поэтому превраще-ние сукцинилкофермента А в анион янтарной кислоты (сукцинат) идет с образованием другого макроэргического вещества, аналога аденозинтрифосфата – гуанозинтри-фосфата:

Янтарная кислота дегидрируется FAD-зависимым ферментом и превращается в фума-ровую кислоту, которая превращается в L-яблочную кислоту (малат) в результате гидратации фумаразой:
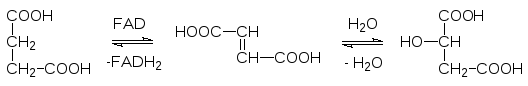
И, наконец, L-малат-дегидрогеназа переводит яблочную кислоту в оксалоацетат, с реак-ции которого с ацетил-коферментом А начиналась эта цепочка превращений:

Роль щавелевоуксусной кислоты в биохимии не ограничивается участием в цикле Кребса. Она может быть предшественником аспарагиновой кислоты и аспарагина (правда, она может быть также получена из этих аминокислот), из цикла Кребса могут привлекаться для иных обменных процессов и другие его участники, например, кетоглутаровая кислота для образования глютаминовой кислоты и глютамина, щаве-левоуксусная кислота – это также исходный продукт для образования глюкозы при недостатке ее в пище, не исключены также просто сбои в системе транспорта и превращения участвующих в цикле Кребса веществ, которые приводят к потере оксалоацетата. Поэтому должен существовать автономный механизм образования окса-лоацетата. Этот биохимический процесс относится к анаболическим, но он является неотъемлемой частью цикла Кребса и поэтому есть смысл рассмотреть его в этом разделе.
Процесс, в котором образуются промежуточные продукты многостадийных биохими-ческих превращений в общем случае называют анаплерозом. Исходным продуктом для образования оксалоацетата является пируват, который карбоксилируется бикарбонат-ным анионом с участием аденозинтрифосфата в активном центре соответствующей карбоксилазы. Положительным эффектором этого фермента служит ацетил-кофермент А, то есть при отсутствии в клетках свободного ацетил-кофермента А биосинтез окса-лоацетата не идет. В активном центре карбоксилазы имеется простетическая группа, образованная биотином за счет ацилирования его карбоксильной группой аминогруппы из лизинового фрагмента апоферментной составляющей:

Используя энергию АТФ, пируваткарбоксилаза ацилируется по атому азота мочевин-ного фрагмента бикарбонатом с образованием аллофанатного фрагмента:

Это происходит в одном участке активного центра, затем присоединенный на длинной цепочке гетероциклический структурный элемент, несущий карбоксилатную группу, перемещается в другой участок активного центра и там отдает ее пирувату с образованием оксалоацетата:

