
Ферменты
Катализаторами химических превращений в живых клетках являются вещества белко-вой природы, которые называют ферментами или энзимами. Здесь не только чисто лингвистическое расхождение. На начальном этапе развития биохимии шел спор меж-ду Л.Пастером с одной стороны и М.Бертло и Ю.Либихом с другой. Л.Пастер был убежден в том, что процесс брожения неотделим от дрожжевых клеток и осуществля-ющие это превращение катализаторы – организованные ферменты (от лат. fermentum – закваска) – от клеток неотделимы. М.Бертло и Ю.Либих оперировали понятием энзим (от гр. en - в, zyme - дрожжи, закваска), относя его к секретируемым клетками ката-лизаторам пищеварительных процессов – пепсину, трипсину, амилазе и др. Заблужде-ние Пастера было основано на том, что он проводил стерилизацию клеточных культур нагреванием, при котором шла и денатурация ферментов, а М.Бертло и Ю.Либих рабо-тали с ферментами из пищеварительных соков, не проводя их термическую обработку. В соответствии с этим одни и те же биокатализатры вне продуцирующей их клетки принято назвать энзимами, то есть ферменты в составе стирального порошка или таб-летки фестала – это энзимы. В биохимии, рассматривающей обменные процессы в клетках, речь обычно идет о ферментах, хотя относящийся к ним раздел биохимии называют энзимологией для того чтобы понятие было составлено только из греческих слов.
Работу ферментов выбрал для иллюстрации особенности биохимических процессов известный биохимик Сент-Дьердь. Он напомнил, что в гробнице Тутанхамона несколь-ко тысяч лет пролежала высохшая трапеза фараона, оставленная ему для загробной жизни. Будучи съеденной она превратилась бы в диоксид углерода, воду и другие продукты метаболизма в считанные часы.
Надо сказать, что начало биохимии в нашем сегодняшнем понимании было положено работами Э.Бухнера, показавшего, что после длительного перемешивания дрожжевых клеток с инфузорной землей происходит их разрушение, но полученный бесклеточный сок некоторое время сохраняет способность к сбраживанию глюкозы. На самом деле аналогичные опыты ставились намного раньше, например, за 25 лет до публикации Э.Бухнера появилась статья на эту тему М.М.Манасеиной (Коркуновой) на русском и немецком языках, были и более ранние сообщения.
Что же отличает ферменты, как катализаторы? В общем можно выделить три особенности:
-
Высокая эффективность. Под этим подразумевается, что реакция, которая в обыч-ных условиях идет очень медленно или вообще не идет, в присутствии фермента или мультиферментного комплекса протекает с очень высокой скоростью. Правда, скорость при этом понятие относительное. Если одна молекула пепсина вызывает расщепление примерно десяти пептидных связей в секунду, то молекула каталазы, разлагающая пероксид водорода на воду и кислород, осуществляет до миллиона превращений в секунду.
-
Ферменты высокоспецифичны по типу реакций, то есть каждый фермент катализи-рует только одну реакцию, например, глютаминовая кислота в присутствии соот-ветствующей декарбоксилазы превращается в -аминомасляную кислоту, а фермент, относящийся к трансаминазам, превращает ее в кетоглутаровую кислоту.
-
Ферменты чаще всего специфичны по субстрату. Например, превращение оксигруп-пы в карбонильную группу осуществляют ферменты, относящиеся к дегидрогена-зам, но этанол превращается в ацетальдегид алкогольдегидрогеназой, а молочная кислота в пировиноградную – лактатдегидрогеназой.
Из этого следует, что ферментов, осуществляющих все многообразие метаболических превращений, должно быть очень много. В 1930 году было известно всего лишь 80 ферментов, а в 1994 году – 3200. Долгое время безуспешно искали ферменты не только среди белков, но и среди других классов биополимеров, и лишь в последние годы было показано, что превращения определенных субстратов могут катализировать и некото-рые рибонуклеиновые кислоты, названные рибозимами.
Ферменты, выделенные и охарактеризованные на ранней стадии развития биохимии, получали имена собственные (трипсин, пепсин, тромбин), затем названия ферментов стали образовывать по названию субстратов с окончанием -аза (аргинин аргиназа, аспарагин аспарагиназа, мочевина уреаза и т.д.), но чаще всего название суб-страта дополняют типом осуществляемого ферментом химического превращения (лак-татдегидрогеназа, холинэстераза, супероксиддисмутаза). Обилие таких названий может напугать приступающего к изучению биохимии, но этот испуг легко преодолим, так как в конце концов даже специалисты имеют обычно дело с ограниченным числом биохимических превращений. Если выделять из биохимии раздел энзимологии, то такая путаница в названиях становится слишком обременительной, и поэтому была принята цифровая классификация ферментов, включающая четыре группы цифр: класс, подкласс, подподкласс и номер фермента в подподклассе. Исторически выделилось шесть групп ферментов.
Первая группа представлена оксидоредуктазами, они относятся к классу 1. Здесь можно выделить подкласс дегидрогеназ, то есть в число оксидоредуктаз входят фер-менты, катализирующие дегидрирование спиртовых групп до карбонильных групп, окисление карбонильных групп до карбоксильных, дегидрирование с образованием этиленовых соединений, дегидрирование групп СН-NН2, приводящее к образованию гидролизующихся до карбонильных групп иминов (C=NH), и так далее. Реакции дегид-рирования протекают по схеме:
![]()
Если атомы водорода или электроны непосредственно переносятся на кислород, то такие ферменты относятся к подклассу оксигеназ.
Второй класс представлен трансферазами - это ферменты, катализирующие перенос многоатомных фрагментов с одной молекулы на другую. Сюда входят, например, фер-менты, переносящие фосфатные остатки с аденозинтрифосфата на другие молекулы (фосфофруктокиназа), ферменты, переносящие одноуглеродные фрагменты (фолат-зависимые ферменты). Трансаминазы, обменивающие аминогруппы на карбонильные функции, также относятся к трансферазам.
Ферменты третьего класса называют гидролазами. Они катализируют перенос двух фрагментов молекулы на молекулу воды, то есть реакцию гидролиза. Если они гид-ролизуют пептидные связи в белках, то это протеазы или пептидазы. Отщепление С‑концевой аминокислоты катализирут карбопептидазы, а N-концевой – аминопепти-дазы. Катализ гидролитического расщепления нуклеиновых кислот осуществляют нуклеазы (ДНК-аза, РНК-аза).
Четвертый класс ферментов – это лиазы. Они катализируют расщепление субстрата с образованием кратной связи или, в обратном направлении, – присоединение по крат-ной связи (в этом варианте обратной реакции их называют обычно синтазами). В качестве примера можно привести карбоангидразу, катализирующую реакцию образо-вания бикарбоната из диоксида углерода и воды:
![]()
Еще один пример – декарбоксилазы:

К пятой группе относятся изомеразы. Это название уже характеризует тип катализи-руемых этими ферментами превращений. Можно только добавить, что наряду с прос-тыми изомеризациями, связанными, например, с переносом ацильной (фосфориль-ной) группы с одной гидроксильной группы на другую, изомеразы катализируют и бо-лее сложные реакции. Например, к ним относятся рацемазы и эпимеразы (если речь идет о получении другого диастереоизомера), а кобаламинзависимые изомеразы по свободнорадикальному механизму катализируют и перестройку углеродного скелета молекул. С их участием, например, метилмалоновая кислота в виде ее тиоэфира с коферментом А превращается в сукцинил-кофермент А:

Шестая группа ферментов – лигазы (синтетазы). Главная особенность этих ферментов состоит в том, что энергию, требуемую для протекания катализируемых ими превра-щений, поставляют макроэргические вещества, главным из которых является АТФ. Примером катализируемых лигазами реакций служит образование C-N, C-S и С-С-свя-зей (например, это образование пептидных связей, тиоэфиров и т.д.).
Набор функциональных групп в белковых аминокислотах не велик и с их помощью белковая молекула не может обеспечить катализ всех требуемых для протекания мета-болических процессов реакций. Вследствие этого во многих случаях к работе фермента подключаются вещества небелковой природы, которые могут быть связаны с белковой молекулой ковалентными связями, солевыми связями или же они могут образовывать более или менее прочные комплексы с белковой частью фермента, которую тогда на-зывают апоферментом. Связанные ковалентной связью небелковые составляющие фер-ментов обычно называют простетическими группами, а связанные с апоферментами водородными связями, солевыми, Ван-дер-Ваальсовыми или гидрофобными взаимо-действиями небелковые компоненты называют коферментами (в последнее время вхо-дит в употребление термин косубстрат, то есть вспомогательный субстрат). Облада-ющий каталитической активностью комплекс кофермента и апофермента, если это надо подчеркнуть, называют холоферментом. Кофермент или простетическая группа отвечает за химизм катализируемого превращения. Она также стабилизирует апофер-мент – вместе у них наиболее выгодная в энергетическом отношении структура, поэто-му апофермент без кофермента более легко денатурируется. Но белковая компонента не только определяет специфичность фермента по субстрату, обеспечивает связывание с субстратом и отход от каталитического центра продуктов реакции. В отдельных слу-чаях она определяет и химизм катализируемой реакции (активные центры трансаминаз и декарбоксилаз аминокислот включают один и тот же кофермент – пиридоксальфос-фат). Кроме коферментов или простетических групп в состав ферментов могут входить и кофакторы – чаще всего это ионы металлов, известные нам как микроэлементы.
Существуют, конечно, и ферменты, каталитический центр которых составлен только функциональными группами аминокислот, но и они чаще всего наиболее активны при наличии в их структуре кофакторов. Так, например, в работе каталитического центра сериновых гидролаз принимает участие ион цинка.
Особую роль в метаболических процессах играют аллостерические ферменты, молеку-лы которых, кроме каталитических центров, имеют еще и регуляторные участки. В ре-зультате связывания с ними веществ, называемых эффекторами, активность фермента может возрастать (положительный эффектор) или снижаться (отрицательный). Понят-но, что аллостерические ферменты устроены более сложно и имеют более высокую молекулярную массу.
Строение многих коферментов и простетических групп было установлено еще в трид-цатые годы прошлого века. Оказалось, что чаще всего они образуются в результате более или менее сложных превращений витаминов. Так, например, витамин В1 или тиамин, входит в состав лиаз, декарбоксилирующих -кетокислоты (пируватдекарбок-силаза, пируватдегидрогеназа, кетоглутаратдегидрогеназа) в виде эфира с пирофосфор-ной кислотой – тиаминпирофосфата:

Кофермент пиридоксальфосфат, принимающий участие в реакциях переаминирования (трансаминазы, относящиеся к трансферазам) и декарбоксилирования аминокислот (лиазы), точно так же образуется в результате монофосфорилирования витамина В6 – пиридоксаля:
 и
и 
Более сложная цепочка превращений ведет от витамина В3 – ниацина (так называют никотиновую кислоту и никотинамид) к коферменту реакций гидрирования-дегидрирования – никотинамидадениндинуклеотиду NAD+):
 и
и

Еще одна группа ферментов, принимающих участие в реакциях гидрирования-дегидри-рования, представлена флавопротеинами (FMN и FAD – флавинмононуклеотид и флавинадениндинуклеотид), у которых донором-акцептором атомов водорода является рибофлавин (витамин В2):

Важную роль в окислительно-восстановительных превращениях в биологических сис-темах играют цитохромы (цито – от греч. kytos – вмещающее, клетка; хрома – цвет, окрашивание). В молекулах этих веществ белковая составляющая соединена тиоэфир-ной связью с железопорфирином, молекула которого представляет собой макроцикл из четырех пиррольных колец с метиновыми мостиками, с атомом железа в центре. В качестве примера здесь можно привести структуру гема – железопорфирина, входя-щего в состав гемоглобина и предназначенного для переноса молекулярного кисло-рода. Гем соединен с белковыми молекулами тиоэфирными связями, образовавшимися в результате присоединения сульфгидрильных групп из остатков цистеина по виниль-ным группам гема.

Цитохромы оксидоредуктаз, окрашенные в цвета от красного до коричневого, участ-вуют в переносе электронов (Fe+2 Fe+3 + e), например, когда образовавшиеся в реак-циях дегидрирования атомы водорода отдают соответствующим акцепторам свои электроны и превращаются в протоны. Цитохромы обозначают буквами латинского алфавита с цифровыми индексами, например а, а3, b, c1, с, f6, всего их известно более двадцати. В частности в цитохроме с феррипорфириновый фрагмент вместо остатков пропионовой кислоты содержит пропильные группы. Цитохромы участвуют также в реакциях окислительного гидроксилирования органических соединений, а пара цито-хромоксидаз а-а3 переносит четыре электрона на молекулу кислорода (дыхание).
Часто в учебниках по биохимии в качестве универсального кофермента реакций гидрирования-дегидрирования рассматривается и убихинон (ubi – по латыни значит везде, то есть вездесущий хинон). На самом деле существует несколько соединений этого класса, соответствующих формуле

В частности убихинон с n = 10 выделен из печени млекопитающих (кофермент Q, CoQ), однако это растворимое в клеточных липидах вещество никогда не бывает связано с белками и поэтому не может претендовать на роль истинного кофермента. На самом деле небольшой пул этого соединения растворен в липидном слое клеточных мембран и служит для одно- или двухэлектронного переноса между более жестко встроенными в мембрану переносчиками электронов.
Фолиевая кислота (витамин Вс) после ее превращения в тетрагидрофолиевую кислоту участвует в работе ферментов, переносящих одноуглеродные фрагменты (метильную, гидроксиметильную, формильную группу):
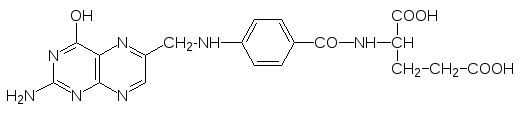

Среди ацилтрансфераз чаще всего встречаются ферменты, в работе которых принимает участие кофермент А, обозначаемый часто CoASH, В этом соединении пирофосфат-ный фрагмент 3-фосфоаденозиндифосфата соединен эфирной связью с пантотеновой кислотой, которая является обязательным фактором питания, иногда ее называют так-же витамином В5.

С участием АТФ или в результате обменной реакции с другим тиоэфиром это соеди-нение ацилируется по сульфгидрильной группе с образованием соответствующего S‑ацильного производного, например ацетил-кофермента А (СоАS-СОСН3) и снова может переносить ацильные группы на другие молекулы по двум механизмам: с раз-рывом связей С-S- или С-Н в -положении к тиокарбоксилатной группе.
В группе лигаз одно из главных мест принадлежит карбоксилазам, у которых простети-ческая группа представлена биотином или витамином Н:

В молекуле фермента карбоксильной группой биотина ацилирована аминогруппа ос-татка лизина, то есть витамин Н принимает участие в образовании простетической группы. Это достаточно стабильное соединение и авитаминоз по нему встречается только у людей, которые едят много сырых яиц, так как яйца содержат белок, который связывает биотин в прочный комплекс. Бициклический фрагмент биотина с мочевин-ной группировкой присоединен к белковой молекуле на длинном поводке из десяти атомов, что обусловлено необходимостью переноса его с минимальной структурной перестройкой из одного участка фермента в другой, так как механизм его действия основан на двух реакциях. Сначала в одном участке фермента протекает его карбокси-лирование бикарбонатом с участием аденозинтрифосфата:

После этого уже в другом участке фермента карбоксильная группа переносится на дру-гую молекулу, например

Одним из наиболее изучаемых витаминов является витамин С – аскорбиновая кислота, однако ее роль в функционировании ферментов до сих пор не установлена во всех ее проявлениях. Предполагается, что она участвует в образовании входящих в состав кол-лагена (белок соединительной ткани) аминокислот 4-гидроксипролина и 5-гидрокси-лизина и поэтому ее присутствие важно для заживления ран. Не исключено и ее учас-тие в ассимиляции неорганического железа.
Сложное строение отличает группу веществ, называемых витамин В12, чаще всего это цианкобаламин.

Витамин В12 представляет собой кобальторганическое соединение, раствор которого в воде окрашен в пурпурный цвет. Он выполняет роль кофермента изомераз, функционирующих по свободнорадикальному механизму. Источниками кобаламина являются бактерии, в частности бактериальная флора пищеварительного тракта; в растениях он отсутствует. Наиболее ярко авитаминоз по этому фактору про-является в нарушении процесса кроветворения.
Из других обязательных факторов питания можно назвать витамин А или ретинол, витамин Е и витамины группы D и группы К. У витамина А в организме несколько функций. Наиболее известна его роль в зрительном процессе, где он в виде ретиналя, образующегося из ретинола,

участвует в образовании реагирующего на свет пигмента родопсина. Но недостаточ-ность по витамину А не ограничивается только «куриной слепотой», это всего лишь первый симптом авитаминоза по этому веществу. При серьезной недостаточности появляется сухость кожи, глаз (ксерофтальмия), задержка развития и роста, стериль-ность самцов. Но и гипервитаминоз опасен, особенно для беременных женщин.
Витамин Е или токоферол (от гр. токос – потомство, феро – несу)

является ингибитором свободнорадикальных реакций, его недостаток в рационе вызы-вает перерождение репродуктивных органов, нарушение функций мембран, дегенера-цию печени, но точная биологическая роль витамина Е не установлена. Много этого витамина содержится в растительном масле, тем более, что синтетический витамин Е добавляют сейчас в пищевые продукты специально для замедления процессов полиме-ризации и окисления.
Витамины группы D (они, как отмечалось выше, образуются из эргостерина) относятся скорее к гормонам, так как они регулируют обмен кальция и фосфата, а витамин К – замещенный метилнафтохинон – участвует в работе нескольких факторов свертывания крови, правда, коферментная роль его не установлена.
 и
и

Кинетическое описание ферментативных реакций было предложено Михаэлисом и Ментен. В 1913 году эти исследователи предположили, что фермент и субстрат образуют комплекс (ES, комплекс Михаэлиса),
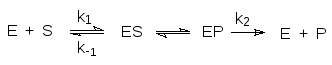
который превращается в комплекс фермента с продуктом превращения субстрата (ЕР), распадающийся далее на фермент и продукт.
Основа катализа – снижение энергии активации реакции, и ферменты по способности снижать ее превосходят все известные катализаторы. Так, например, разложение пер-оксида водорода без катализатора требует энергии активации 18000 кал/моль, самый активный неорганический катализатор – коллоидная платина – снижает ее до 11700 кал/моль, а фермент каталаза обеспечивает снижение энергии активации до величины менее 2000 кал/моль. Сложный эфир – этилбутират – гидролизуется в присутствии кислот с энергией активации 16800 кал/моль, в присутствии щелочей 10200 кал/моль, а панкреатическая липаза характеризуется энергией активации по этому субстрату рав-ной 4500 кал/моль. Очень медленно гидролизуется водой сахароза, в присутствии кислот этот процесс ускоряется (Еа = 25600 кал/моль), а дрожжевая инвертаза снижает этот показатель реакции до 8000-10000 кал/моль. Эта различие в абсолютных вели-чинах выглядит не очень серьезным, но энергия активации в уравнении Аррениуса входит в экспоненциальный множитель

и тогда константа скорости ферментативной реакции (k с индексом е) в логариф-мическом виде представляется уравнением

а константа скорости реакции, катализируемой протонами (индекс h), уравнением

Постоянные реакций Вe и Вh примерно равны и тогда для температуры 37С получаем

что соответствует соотношению ke/kh = 2,51012 (двенадцать порядков!).
Что же лежит в основе уникальной избирательности и высокой каталитической актив-ности ферментов? Прежде всего это особенность пространственного строения белко-вой молекулы, лежащей в основе этих катализаторов. Форма глобулярного белка во многом определяется гидрофобными взаимодействиями между структурными элемен-тами входящих в его состав аминокислот. Эти взаимодействия слабы, но когда их много – они дают серьезный выигрыш в энергии. Гидрофобные структурные элементы заполняют внутреннюю среду белковой глобулы, однако слабость каждого отдельного взаимодействия позволяет белку в ответ на воздействие на внешнюю сферу в резуль-тате изменения рН или присоединения другой молекулы легко перестраиваться, прини-мая новую форму и меняя местами различные функциональные группы боковых цепей аминокислотных фрагментов (сухой и мокрый песок). Еще Э.Фишер выдвинул гипо-тезу о взаимодействии субстрата с активным центром фермента по принципу «ключ-замок». Очень часто и сейчас используют этот подход для схематического изображе-ния ферментативного катализа, но эта схема слишком упрощена, она не отражает того, что в ответ на связывание с субстратом происходит перестройка белковой молекулы фермента, и тогда образующемуся комплексу соответствует минимум энергии уже при ином расположении составляющих фермент структурных элементов, а по мере проте-кания ферментативной реакции такие перестройки могут происходить неоднократно до отхода продукта реакции от реакционного центра.
Первым белком для которого была установлена третичная структура стал миоглобин. Его молекула представляет собой комплекс белка и небелковой гемовой структуры. Биологическая роль миоглобина заключается в транспорте кислорода внутри клетки и в создании запаса кислорода внутри клетки для восполнения его недостатка в экстрен-ных ситуациях. Гемовые структуры присутствуют во многих белках с каталитическими и транспортными функциями. Атом железа, находящийся в центре порфириновой гете-роциклической компоненты гема, может связывать молекулу кислорода или же пере-носить электроны, меняя валентность от +2 до +3 и обратно. В гемоглобинах, предназ-наченных для переноса кислорода, у атома двухвалентного железа с координационным числом равным 6 пять координаций заняты атомами азота: четыре из порфиринового макроцикла, а пятая, в перпендикулярном к плоскости молекулы гема направлении, занята атомом азота из имидазольного цикла фрагмента гистидина, входящего в пеп-тидную цепочку белковой компоненты гемоглобина. Шестая противоположно направ-ленная координация служит для связывания кислорода. Эта связь может заниматься и другими молекулами, так например, монооксид углерода связывается таким гемом в гемоглобине в 200-250 раз прочнее чем кислород.
Рентгеноструктурный анализ кристаллического миоглобина позволил установить его пространственное строение – третичную структуру. Расшифровка структуры прово-дилась в несколько этапов. Сначала на рентгенограмме низкого разрешения было уста-новлено пространственное расположение полипептидной цепи. Затем в результате съемки с более высокой разрешающей способностью была получена рентгенограмма, позволившая установить положение тяжелых атомов, составляющих боковые фраг-менты полипептидной цепи.
Оказалось, что в миоглобине около 80 % всех аминокислотных остатков (всего их 159) включено в -спирали, образующие 8 почти прямолинейных участков, из которых са-мый длинный включает 23 аминокислотных фрагмента, а самый короткий 7. Все четы-ре входящих в состав этого белка молекулы пролина образуют изгиб полипептидной цепи. Все полярные функциональные группы, кроме двух, расположены на наружной поверхности белковой глобулы, а большая часть гидрофобных групп внутри ее. Моле-кула миоглобина настолько компактна, что внутри ее могут поместиться всего лишь четыре молекулы воды. Из различных клеток было выделено несколько разновид-ностей миоглобина, но все они очень близки по форме глобул. Оказалось также, что в некоторых ключевых точках полипептидных цепей разных миоглобинов находятся одинаковые аминокислотные составляющие. Такие аминокислоты называют инвари-антными.
Строение миоглобина, 80 % пептидных фрагментов которого включено в -спирали, определяется его ролью переносчика кислорода. Такая структура с жестким каркасом мало приспособлена для многообразных конформационных переходов. В отличие от этого в молекулах ферментов в -спирали включено обычно не более 40 % аминокис-лотных составляющих, но именно -спирали образуют активные центры ферментов и предназначенные для связывания с другими молекулами участки рецепторов и регуля-торных белков.
Миоглобин не содержит складчатых -структур, но эти элементы третичной структуры белков обязательны для подавляющего большинства ферментов. В качестве примера можно привести защитный белок с гидролазной активностью лизоцим (лизис – раз-рыв, растворение). Он содержится яичном белке, в слезах и в слюне, а его антимик-робная активность основана на расщеплении олигосахаридных фрагментов, участвую-щих в образовании клеточной стенки многих бактерий. В ‑структуры молекулы лизо-цима включено 12 % аминокислотных фрагментов, в -спирали – 40 %, а остальные образуют различные изгибы и иррегулярные витки. Активный центр лизоцима пред-ставлен только -спиралями.
Еще один пример структурной организации – это предназначенный для гидролитичес-кого расщепления рибонуклеиновых кислот фермент рибонуклеаза. Он секретируется клетками поджелудочной железы в двенадцатиперстную кишку и далее поступает в тонкий кишечник. Молекула рибонуклеазы состоит из 124 молекул аминокислот, из них 26 % в составе участков, образующих -спирали, и 35 % находятся в ‑структурах. Нативная конфигурация рибонуклеазы поддерживается четырьмя дисульфидными мостиками.
Одной из главных особенностей ферментов является реализуемая с их помощью воз-можность использования свободной химической энергии, заключенной в таких макро-эргических веществах как аденозинтрифосфат, для осуществления эндотермических реакций, а также синтез аденозинтрифосфата за счет использования энтропийного фак-тора. Однако и без этого ферменты представляют собой уникальные катализаторы.
