
- •Министерство образования и науки Российской Федерации
- •Основы общей химии
- •Глава 1 Первоначальные понятия химии
- •1.1. Предмет химии
- •1.2. Атомно-молекулярное учение
- •1.3. Основные понятия химии
- •1.3.1. Простые и сложные вещества
- •1.3.2. Атомная и молекулярная массы
- •1.3.3. Моль, молярная масса, молярный объем
- •1.3.4. Связь между массой вещества и его количеством
- •1.3.5. Связь между объемом вещества и его количеством
- •1.3.6. Валентность, степень окисления
- •1.4. Уравнения химических реакций
- •2 Моль атомов н - 1 моль молекул н2,
- •1.5. Вопросы для самоконтроля по теме
- •1.6. Примеры комплексных тестов для самоконтроля знаний по теме «Первоначальные понятия химии» Вариант № 1
- •1. 17, 2. 35,5, 3. 71 Г/моль, 4. 71 г, 5. 71?
- •Вариант № 2
- •1. 0,233, 2. 233, 3. 233 Г/моль, 4. 104, 5. 233 г.
- •Вариант № 3
- •1.7. Тесты и задачи для самоподготовки по теме
- •1) Воздух, 2) речная вода, 4) хлорид меди (II), 8) нефть,
- •16) Природный газ, 32) раствор соляной кислоты*.
- •1) Гашеная известь**, 2) соляная кислота, 4) резина, 8) квасцы**, 16) хлорная вода**
- •1) Мел, 2) пирит*, 4) цемент, 8) бензол, 16) глюкоза.
- •1)Гидроксид натрия, 2) оксид фосфора (V), 4) гашеная известь**,
- •8) Бензин, 16) сахароза.
- •1.7.3. Простые и сложные вещества
- •1) В состав нитрата железа входят железо, азот и кислород,
- •1) Молекула водорода, состоящая из двух атомов, 2) две молекулы водорода, 4) два атома водорода, 8) два моль атомов водорода, 16) два моль молекул водорода.
- •1) Имеет размерность г/моль, 2) численно равна значению молярной массы элемента, 4) равна отношению массы атома к массе 1 а.Е.М,
- •8) Может быть выражена в граммах, 16) может быть выражена в атомных единицах массы, 32) является безразмерной величиной.
- •1.7.5. Валентность, степень окисления
- •1.7.6. Расчеты по химическим формулам
- •1.7.7. Моль – единица измерения количества вещества
- •6,02·10 23 Атомов Cu – 64 г,
- •1 Атом Cu – х г;
- •1) 34 Г, 2) 34 г/моль, 4) 1,99 · 1022, 8) 34 а.Е.М., 16) 5,65 · 1023 г.
- •1.7.8. Ответы к комплексным заданиям для тестирования знаний по теме «Первоначальные понятия химии» Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •6,02 ·1023 Молекул 98 г,
- •10 Молекул х г;
1.3.3. Моль, молярная масса, молярный объем
Одной из основных единиц в Международной системе единиц (СИ) является единица количества вещества – моль.
Моль – это такое количество вещества, которое содержит столько структурных единиц данного вещества (молекул, атомов, ионов и др.), сколько атомов углерода содержится в 0,012 кг (12 г) изотопа углерода 12С.
Учитывая, что значение абсолютной атомной массы для углерода равно m(C) = 1,99 · 1026 кг, можно рассчитать число атомов углерода NА, содержащееся в 0,012 кг углерода.
Моль любого вещества содержит одно и то же число частиц этого вещества (структурных единиц). Число структурных единиц, содержащихся в веществе количеством один моль равно 6,02·1023 и называется числом Авогадро (NА).
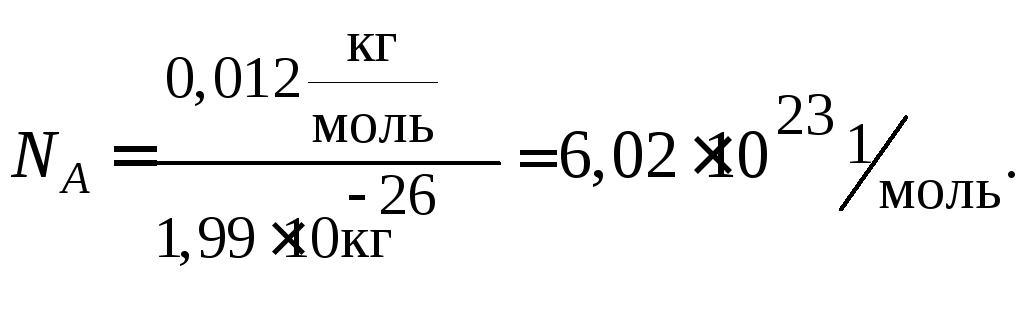
Например, один моль меди содержит 6,02·1023 атомов меди (Cu), а один моль водорода (H2) – 6,02·1023 молекул водорода.
Молярной массой (M) называется масса вещества, взятого в количестве 1 моль.
Молярная масса обозначается буквой М и имеет размерность [г/моль]. В физике пользуются размерностью [кг/кмоль].
В общем случае численное значение молярной массы вещества численно совпадает со значением его относительной молекулярной (относительной атомной) массы.
Например, относительная молекулярная масса воды равна:
Мr(Н2О) = 2Аr (Н) + Аr (O) = 2∙1 + 16 = 18 а.е.м.
Молярная масса воды имеет ту же величину, но выражена в г/моль:
М (Н2О) = 18 г/моль.
Таким образом, моль воды, содержащий 6,02·1023 молекул воды (соответственно 2·6,02·1023 атомов водорода и 6,02·1023 атомов кислорода), имеет массу 18 граммов. В воде, количеством вещества 1 моль, содержится 2 моль атомов водорода и один моль атомов кислорода.
1.3.4. Связь между массой вещества и его количеством
Зная массу вещества и его химическую формулу, а значит и значение его молярной массы, можно определить количество вещества и, наоборот, зная количество вещества, можно определить его массу. Для подобных расчетов следует пользоваться формулами:
ν = m / M,
m = ν · M,
где ν – количество вещества, [моль]; m – масса вещества, [г] или [кг]; М – молярная масса вещества, [г/моль] или [кг/кмоль].
Например, для нахождения массы сульфата натрия (Na2SO4) количеством 5 моль найдем:
1) значение относительной молекулярной массы Na2SO4, представляющую собой сумму округленных значений относительных атомных масс:
Мr(Na2SO4) = 2Аr(Na) + Аr(S) + 4Аr(O) = 142,
2) численно равное ей значение молярной массы вещества:
М(Na2SO4) = 142 г/моль,
3) и, наконец, массу 5 моль сульфата натрия:
m = ν · M = 5 моль · 142 г/моль = 710 г.
Ответ: 710.
1.3.5. Связь между объемом вещества и его количеством
При нормальных условиях (н.у.), т.е. при давлении р, равном 101325 Па (760 мм. рт. ст.), и температуре Т, равной 273,15 К (0 С), один моль различных газов и паров занимает один и тот же объем, равный 22,4 л.
Объем, занимаемый 1 моль газа или пара при н.у., называется молярным объемом газа и имеет размерность литр на моль.
Vмол = 22,4 л/моль.
Зная количество газообразного вещества (ν) и значение молярного объема (Vмол) можно рассчитать его объем (V) при нормальных условиях:
V = ν · Vмол,
где ν – количество вещества [моль]; V – объем газообразного вещества [л]; Vмол = 22,4 л/моль.
И, наоборот, зная объем (V) газообразного вещества при нормальных условиях, можно рассчитать его количество (ν):
ν = V /Vмол.
