
- •Министерство образования и науки Российской Федерации
- •ДВИГАТЕЛЬНЫЕ БЕЛКИ
- •белки актомиозиновой системы подвижности
- •Рис. 7. Схема, показывающая изменение положения головки миозина (S1) относительно тонкой нити в ходе структурных перестроек актомиозинового комплекса, которые приводят к возникновению силы, тянущей хвост миозина.
- •Рис. 8. Химические и механические события во время четырех стадий рабочего цикла поперечных мостиков.
- •БЕЛКИ МИКРОТРУБОЧЕК
- •Рис. 12. Схема перемещения молекулы кинезина вдоль микротрубочки, состоящей из мономеров тубулина α и β. Буквами Т и D обозначены головки кинезина, с которыми связаны соответственно АТФ (АТР) или АДФ (ADP).
- •ЛИТЕРАТУРА:
БЕЛКИ МИКРОТРУБОЧЕК
Отдельную группу белков цитоскелета составляют белки микротрубочек. К ним относятся тубулин, белки, ассоциированные с микротрубочками (МАР 1, МАР 2, МАР 4, тау и др.) и белки - транслокаторы (динеин, кинезин, динамин). Микротрубочки – это белковые трубчатые структуры диаметром около 25 нм и длиной до нескольких десятков микрометров; толщина их стенок – около 6 нм. Они являются обязательным компонентом цитоплазмы эукариотических клеток. Микротрубочки образуют веретено деления (ахроматиновую фигуру) в митозе и в мейозе, аксонему (центральную структуру) подвижных ресничек и жгутиков, стенку центриолей и базальных телец. Микротрубочкам отводится важная, если не ключевая, роль в клеточном морфогенезе и в некоторых видах клеточной подвижности.
ТУБУЛИН
Стенки микротрубучек построены из белка тубулина, на долю которого приходится 90% по весу. Тубулин – это глобулярный белок, существующий в виде димера α- и β-субъединиц с молекулярной массой ~55 кДа. Микротрубочка имеет форму полого цилиндра, стенка которого состоит из линейных цепочек тубулиновых димеров, так называемых протофиламентов. В протофиламентах α- субъединица предыдущего димера соединена с β-субъединицей следующего. Димеры в соседних протофиламентах смещены друг относительно друга, образуя спиральные ряды. На попереченом срезе видно 13 димеров тубулина, что соответствует 13 протофиламентам в
18
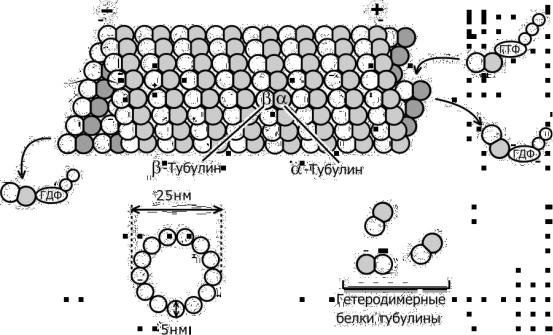
стенке микротрубочки (рис. 9). Каждая субъединица содержит около 450 аминокислот и аминокислотные последовательности субъединиц гомологичны друг другу примерно на 40%. Тубулин – ГТФсвязывающий белок, причем β-субъединица содержит лабильно связанную молекулу ГТФ или ГДФ, способную обмениваться с ГТФ в растворе, а α-субъединица – прочно связанную молекулу ГТФ.
Рис. 9. Строение микротрубочки.
Тубулин способен к спонтанной полимеризации in vitro. Такая полимеризация возможна при физиологических температурах и благоприятных ионных условиях (отсутствие ионов Ca2+) и требует наличия двух факторов: высокой концентрации тубулина и присутствия ГТФ. Полимеризация сопровождается гидролизом ГТФ, и тубулин в составе микротрубочки остается связанным с ГДФ, а неорганический фосфат выходит в раствор.
Полимеризация тубулина состоит из двух фаз: нуклеации и элонгации. При нуклеации происходит формирование затравок, а при
19
элонгации – их удлинение с образованием микротрубочек. Следует отметить, что при полимеризации тубулина субъединицы добавляются только по концам микротрубочек.
Противоположные концы микротрубочек различаются по скоростям роста. Быстрорастущий конец принято называть плюсконцом, а медленнорастущий – минус-концом микротрубочки (см. рис. 9). В клетке ( –)-концы микротрубочек, как правило, ассоциированы с центросомой, а (+)-концы направлены к периферии и нередко доходят до самого края клетки.
Микротрубочки подвержены динамической нестабильности.
При постоянном количестве полимера происходит спонтанный рост или укорочение отдельных микротрубочек вплоть до полного их исчезновения. Из-за запаздывания гидролиза ГТФ по отношению к встраиванию тубулина на конце микротрубочки, находящейся в процессе роста, формируется ГТФ-кэп, состоящий из 9-18 молекул ГТФ-тубулина. ГТФ-кэп стабилизирует конец микротрубочки и способствует ее дальнейшему росту. Если же скорость включения новых гетеродимеров оказывается меньше скорости гидролиза ГТФ или в случае механического разрыва микротрубочки, образуется конец, лишенный ГТФ-кэпа. Такой конец обладает пониженным сродством к новым молекулам тубулина; он начинает разбираться.
Полимеризацию и деполимеризацию микротрубочек индуцируют изменениями температуры, ионных условий или использованием специальных химических агентов. Среди веществ, вызывающих необратимую разборку, широко используются индольные алкалоиды (колхицин, винбластин, винкристин и др.).
20
БЕЛКИ, АССОЦИИРОВАННЫЕ С МИКРОТРУБОЧКАМИ
Белки, ассоциированные с микротрубочками, делятся на две группы: структурные МАР (microtubule-associated proteins) и белки-
транслокаторы.
Структурные МАР
Общим свойством структурных МАР является их перманентная ассоциация с микротрубочками. Еще одним общим свойством этой группы белков является то, что в отличие от белков-транслокаторов при взаимодействии с тубулином все они связываются с С-концевой частью молекулы размером около 4 кДа.
Различают высокомолекулярные МАР 1 и МАР 2, белки тау с молекулярной массой порядка 60-70 кДа и МАР 4 или МАР U с молекулярной массой около 200 кДа.
Так, молекула МАР 1В (представитель группы белков МАР 1) – это стехиометрический комплекс одной тяжелой и двух легких цепей, представляет собой вытянутую палочкообразную молекулу длиной 190 нм, имеющую на одном конце глобулярный домен диаметром 10 нм (по-видимому, участок связывания с микротрубочками); его молекулярная масса составляет 255.5 кДа.
МАР 2 – термостабильный белок. Он сохраняет способность взаимодействовать с микротрубочками и оставаться в их составе в нескольких циклах сборки-разборки после нагревания до 90оС.
Структурные МАР способны стимулировать инициацию и элонгацию и стабилизировать готовые микротрубочки; сшивать микротрубочки в пучки. В таком сшивании участвуют короткие α-
21
спиральные гидрофобные последовательности на N-конце МАР и тау, замыкающие молекулы МАР, сидящие на соседних микротрубочках, наподобие застежки «молния». Биологическая роль такого сшивания может состоять в стабилизации структур, образованных микротрубочками в клетке.
На сегодняшний день экспериментальными исследованиями установлено, что помимо регуляции динамики микротрубочек структурные МАР имеют еще две основные функции: клеточный морфогенез и участие во взаимодействии микротрубочек с другими внутриклеточными структурами.
Белки-транслокаторы
К отличительной особенности белков этой группы относится свойство преобразовывать энергию АТФ в механическое усилие, способное перемещать частицы вдоль микротрубочек или микротрубочки вдоль субстрата. Соответственно транслокаторы являются механохимическими АТФазами, и их АТФазная активность стимулируется микротрубочками. В отличие от структурных МАР, транслокаторы ассоциированы в микротрубочками только в момент АТФ-зависимого перемещения.
Белки-транслокаторы делятся на две группы: кинезиноподобные белки (опосредуют движение от (–)-конца к (+)-концу микротрубочек) и динеинопободные белки (движение от (+)-конца к (–)- концу микротрубочек) (рис. 10).
Кинезин представляет собой тетрамер двух легких (62 кДа) и двух тяжелых (120 кДа) полипептидных цепей. Молекула кинезина
22
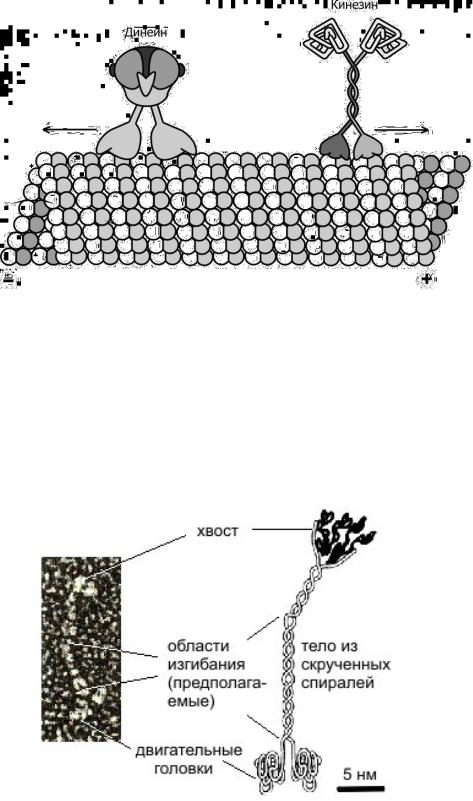
имеет форму стержня диаметром 2-4 нм и длиной 80-100 нм с двумя глобулярными головками на одном конце и веерообразным расширением на другом (рис. 11).
Рис. 10. Белки-транслокаторы.
В середине стержня находится шарнирный участок. N-Концевой фрагмент тяжелой цепи размером около 50 кДа, обладающий механохимической активностью, называется моторным доменом кинезина.
Рис. 11. Строение молекулы кинезина.
23
