
Organicheskaya_khimia
.pdf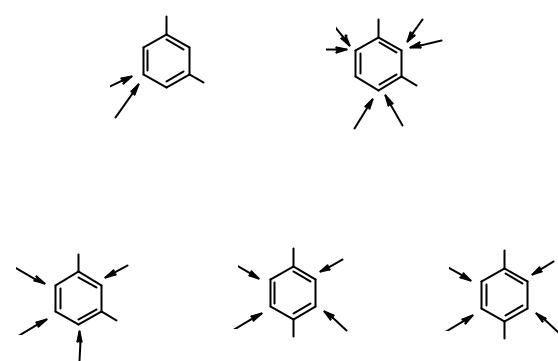
•согласованная ориентация;
•несогласованная ориентация.
Вслучае согласованной ориентации заместители направляют входящую группировку в одно и то же положение (положения) кольца. При несогласованном действии входящая группа может оказаться в самых разных положениях цикла. Планировать синтез тризамещенных бензолов надо так, чтобы образовывалось как можно меньше изомеров, т.е. в дизамещенных бензолах должна быть согласованная ориентация. Некоторые примеры согласованной и несогласованной ориентации приведены ниже.
|
A1 |
|
d1 |
D1 |
d1 |
|
|
|
|
|
d2 |
|
d2 |
|
|
|
|
|
|
|
|
|
|
|
a1 |
A2 |
|
|
D2 |
|
|
|
a2 |
|
|
d1 |
d2 |
|
A - акцептор |
|
|
|
|
|
|||
|
согласованная ориентация |
|
|
D - донор |
|||
|
D |
d1 |
D1 |
d1 |
a2 |
A1 |
a2 |
d |
d |
|
|
||||
|
A |
d2 |
|
d2 |
a1 |
|
a1 |
a |
|
D2 |
A2 |
||||
d
несогласованная ориентация
Реакции гомологов бензола с участием боковой цепи
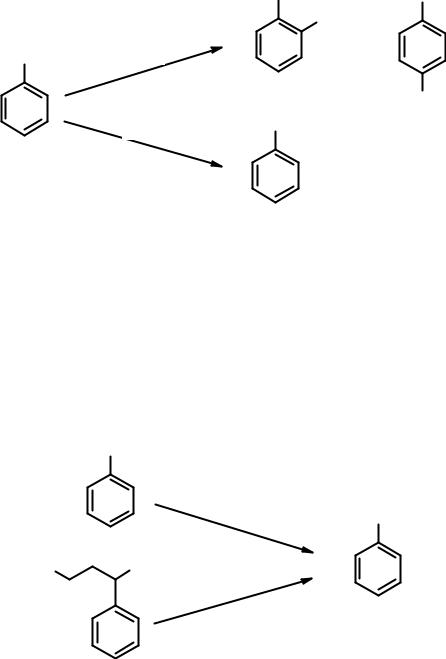
В гомологах бензола с ароматическим циклом связаны алкильные группы, химические свойства которых аналогичных свойствам алканов. Условия реакций в ароматический цикл и боковую цепь заметно отличаются, хотя могут казаться очень похожими. Например:
121
|
CH3 |
CH3 |
|
Cl |
|
Cl2, AlCl3 |
|
+ |
|
|
|
CH3 |
|
|
Cl2, hν |
|
Cl |
CH Cl |
|
|
|
2 |
|
Хлорирование толуола в присутствии кислоты Льюиса проходит в кольцо как ароматическое электрофильное замещение с образованием орто- и пара- хлортолуолов. При облучении реакционной смеси ультрафиолетовым светом протекает цепная свободнорадикальная реакция замещения в боковую цепь, приводящая к бензилхлориду, а при дальнейшем хлорировании – к бензотрихлориду.
Жесткое окисление алкилбензолов приводит к бензойной кислоте или ее производным. Причем результат реакции не зависит от числа углеродов и строения алкильной группы, связанной с циклом.
CH3
[O]
COOH
H3C CH3
[O]
Такое окисление обычно проводят жесткими окислителями, такими как KMnO4, оксиды или соли хрома и т.п. Первоначально в этой реакции образуется альдегид, который обычно не удается выделить, поскольку он окисляется легче, чем углеводород.
Остановить процесс на стадии образования альдегида можно, проводя окисление оксидом хрома (VI) в уксусном ангидриде, с последующим гидролизом диацетата в кислом водном растворе этанола.
122
|
CH3 |
|
|
CH(OCOCH ) |
H O |
|||||||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
3 |
2 |
|
|
|
|
|||
|
|
|
|
|
||||||||||
|
|
|
CrO3, (CH3CO)2O |
|
|
|
|
|
|
H+, H2O, EtOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
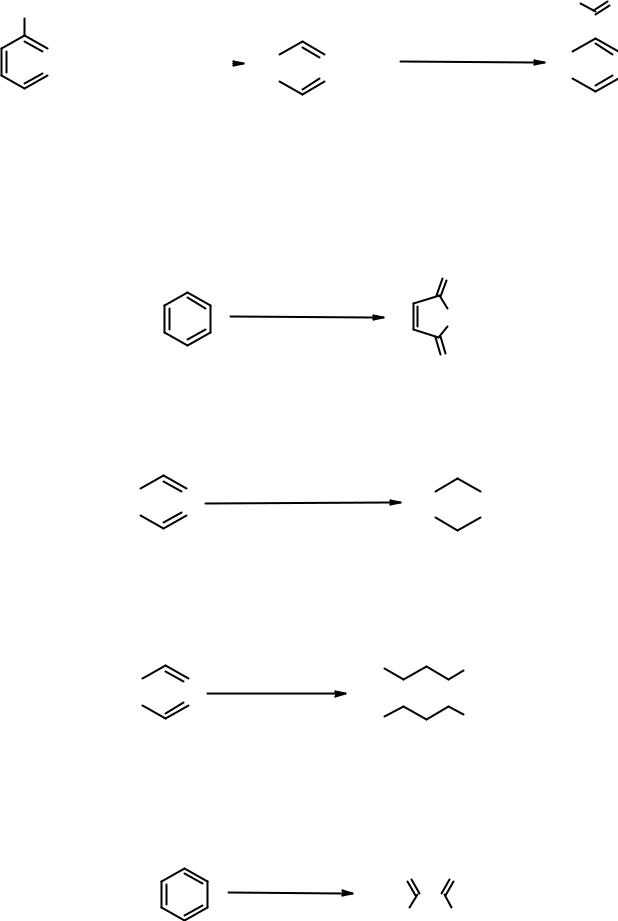
Реакции бензола с нарушением ароматичности
Хотя для бензола нехарактерны реакции, приводящие к потере ароматичности (см. энергию сопряжения), такие превращения известны.
При окислении кислородом воздуха в жестких условиях над оксидом ванадия (V) бензол превращается в малеиновый ангидрид.
O
O2, V2O5, 450o
O
O
Гидрирование (восстановление) бензола возможно в жестких условиях в присутствии гетерогенного катализатора (Pt, Pd, Ni). В результате образуется циклогексан.
|
|
|
H |
, Ni, 180o, давл. |
|
|
|
|
|
|
|
|
||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
Под действием жесткого ультрафиолетового излучения бензол |
||||||||||||||
присоединяет |
три |
молекулы |
хлора, |
превращаясь |
в |
1,2,3,4,5,6- |
||||||||
гексахлорциклогексан. |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
Cl |
|
|
|||||
|
|
|
Cl2 изб, hν |
Cl |
|
|
|
|
Cl |
|
|
|||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
Cl |
|
|
|
|
Cl |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
Cl |
|
|
|||||
Один из девяти стереоизомеров (γ-изомер) гексахлорциклогексана под названием гексахлоран широко использовался в качестве инсектицида.
Озонолиз бензола приводит к единственному альдегиду – глиоксалю.
1) O3 |
O |
|
O |
2) H2O, Zn |
3 |
|
|
|
|
||
H |
|
H |
123
3.2.2.Многоядерные ароматические углеводороды
иих производные
•Углеводороды группы дифенила и трифенилметана. Дифенил, строение, методы получения. Влияние заместителей на сопряжение π-электронов
икопланарность циклов. Реакции SЕAr, ориентация и влияние
функциональных групп в циклах. Трифенилметан, получение, свойства. Реакции, протекающие в бензольные кольца и по sp3-гибридизованному атому углерода. Анионы, катионы и стабильные свободные радикалы в ряду трифенилметана, причины их устойчивости.
Углеводороды группы дифенила и трифенилметана
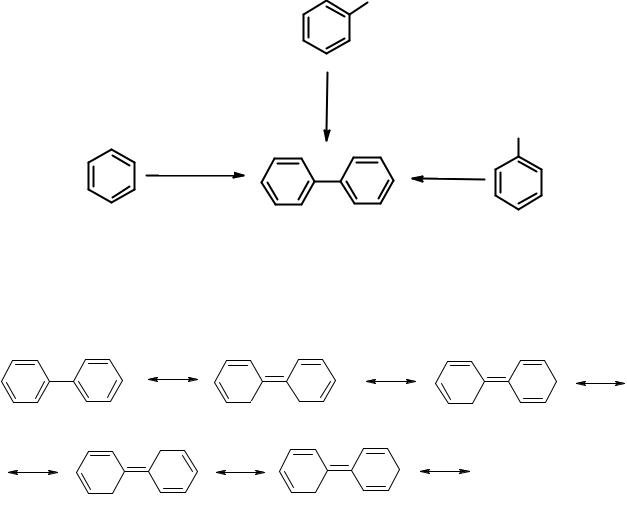
Группа бифенила (дифенила)
Дифенил получен Бертело в 1866 г., пропусканием бензола через раскаленную железную трубку. Кроме того, он может быть синтезирован из йодбензола в присутствии металлической меди или из бромбензола по ВюрцуФиттигу.
I
Cu,
270o Br
Fe, 700o |
Zn |
Каждое из бензольных колец имеет типичное для этой системы строение. Кроме делокализации π-электронов внутри каждого из циклов, имеется сопряжение между ними. Экзоциклическая С-С связь имеет частично двоесвязанный характер. Её длина 1,48 Å – больше двойной, но меньше простой С-С связи.
|
|
- |
+ |
- |
+ |
- |
|
|
|
+ |
и т.д. |
+ |
- |
|
|
|
124
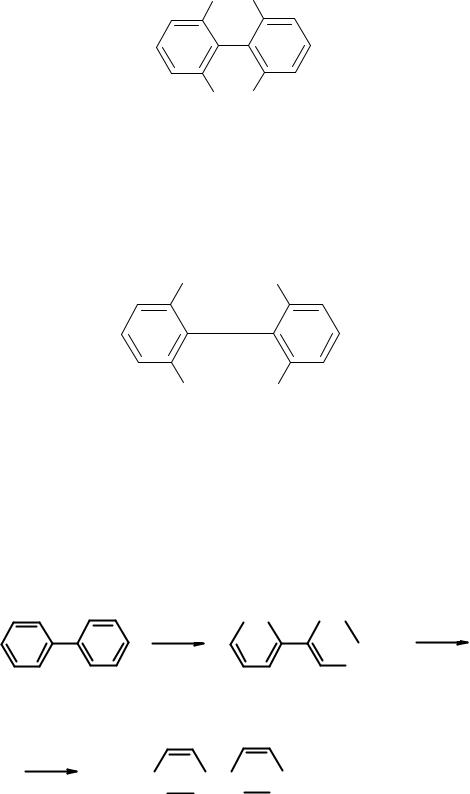
Такая делокализация еще больше увеличивает устойчивость молекулы. Сопряжение максимально, когда кольца находятся в одной плоскости. Однако полностью этого не происходит. Двугранный угол между плоскостями бензольных колец в бифениле 19о в жидкой фазе и 42о – в газовой. Причина в стерических препятствиях – отталкивании орто-водородов.
H H
H H
Водороды в положениях 2,6- и 2’,6’- препятствуют расположению обоих циклов в одной плоскости. Вращение вокруг экзоциклической С-С связи затруднено, но возможно. Оно становится невозможным, если сумма ковалентных радиусов заместителей в о- и о’-положениях больше 2,9 Å. Например, невозможен поворот колец относительно друг друга в о,o’- динитродифеновой кислоте.
NO2 HOOC
COOH O2N o,o'-динитродифеновая кислота
Благодаря отсутствию вращения появляется еще один вид изомерии, который будет обсуждаться позже.
По химическим свойствам бифенил – типичное ароматическое соединение. Для него характерны реакции SEAr. Проще всего рассматривать дифенил как бензол, несущий фенильный заместитель. Последний проявляет слабые активирующие свойства. Все типичные для бензола реакции идут и в бифениле.
+NO |
2 |
|
|
|
|
|
|
|
+NO |
2 |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
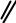
 NO2
NO2
4-нитродифенил
O2N
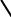

 NO2
NO2
4,4'-динитродифенил
125
Поскольку арильная группа является орто- и пара-ориентантом, реакции SEAr идут преимущественно в пара-положение. Орто-изомер является побочным продуктом вследствие стерических препятствий.
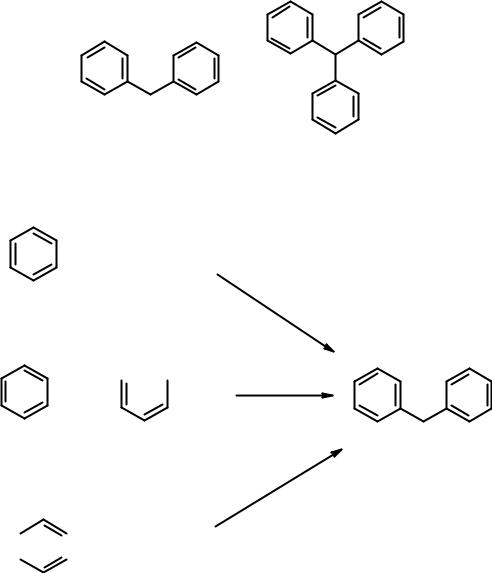
Ди- и трифенилметаны
Ди- и трифенилметаны – гомологи бензола, в которых соответствующее число атомов водорода замещено на фенильные остатки. Бензольные циклы разделены sp3-гибридизованным углеродным атомом, что препятствует сопряжению. Кольца абсолютно изолированы.
дифенилметан трифенилметан
Методы получения дифенилметана:
2 |
+ CH2Cl2 |
AlCl3

 CH2Cl AlCl3
CH2Cl AlCl3
+
H2SO4
2 |
|
|
+ CH2=O |
|
|
||
|
Реакции SEAr протекают в орто- и пара-положения бензольных колец дифенилметана.
Получение трифенилметана и его производных:
126

AlCl3
3C6H6 + CHCl3 |
|
(C6H5)3CH |
|
трифенилметан
AlCl3
3C6H6 + CCl4 |
(C6H5)3CCl |
трифенилхлорметан, но не тетрафенилметан
Отличительная особенность производных трифенилметана – высокая подвижность атома водорода, связанного с тетраэдрическим углеродом.
Трифенилметан проявляет заметную кислотность, вступая в реакцию с металлическим натрием с образованием очень устойчивого трифенилметильного аниона.
|
Ph |
|
|
|
Ph |
|||
|
|
Na |
|
|||||
Ph |
|
|
H |
|
Ph |
|
- Na+ |
|
|
|
|
|
|
||||
|
|
|
|
|
||||
|
|
|
|
|
||||
|
|
Ph |
|
|
|
|
Ph |
|
Трифенилхлорметан в водном растворе диссоциирует с образованием устойчивого карбокатиона.
|
Ph |
|
|
Ph |
|||
Ph |
|
|
Cl |
|
Ph |
|
+ Cl |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
Ph |
|
|
Ph |
||
В некоторых производных трифенилметана разрыв С-Н связи может протекать гомолитически с образованием трифенилметильного радикала – хронологически первого из открытых стабильных свободных радикалов.
Причины высокой стабильности трифенилметильного катиона, аниона и радикала можно понять, рассмотрев строение катиона. Если изобразить трифенилметильный катион с помощью граничных структур, становится понятно, что свободная орбиталь центрального углеродного атома находится в сопряжении с π-электронами бензольных колец.
127
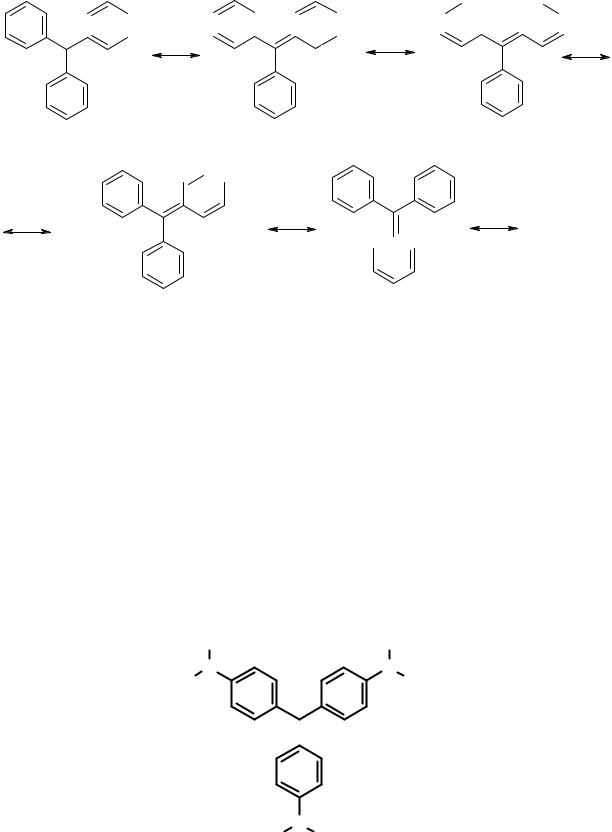
 +
+  +
+ 














+

 +
+
и т.д.
+ 
В результате сопряжения электронная плотность на sp3-углеродном атоме возрастает, приводя к увеличению стабильности карбкатиона.
В трифенилметановых производных недостаток электронной плотности метанового углерода компенсируется ароматическими 6π-электронами трех бензольных колец. Иногда говорят, что положительный заряд «размазан» по всей молекуле. Аналогично (с точностью до наоборот) объясняется стабильность трифенилметильного аниона и радикала. Введение в бензольные кольца заместителей способно заметно увеличить стабильность образующихся в ходе реакций трифенилметильных ионов. Как было показано ранее, донорные заместители стабилизируют катионы, акцепторные – анионы. Наличие в орто- и/или пара-положениях бензольных циклов донорных заместителей увеличивает стабильность трифенилметильного катиона, а акцепторных – аниона. Например, три-(пара-диметиламинофенил)хлорметан (кристаллический фиолетовый) в водном растворе полностью диссоциирован на ионы.
CH3 CH3
H C N |
N CH |
3 |
3 |
|

 +
+
Cl-
N
H3C CH3
краситель кристаллический фиолетовый
128
•Многоядерные ароматические углеводороды с конденсированными ядрами. Линеарные и ангулярные полициклические углеводороды. Выделение их из каменноугольной смолы. Канцерогенные свойства полициклических углеводородов. Техника безопасности при работе с ароматическими углеводородами.
•Нафталин. Изомерия и номенклатура производных. Строение, ароматичность. Химические свойства нафталина и его производных: окисление, каталитическое гидрирование и восстановление натрием в жидком аммиаке, реакции ароматического электрофильного замещения. (влияние заместителей на ориентацию, активность α-положения).
•Антрацен. Номенклатура, строение, ароматичность (в сравнении с бензолом и нафталином), изомерия производных. Реакции окисления и восстановления, электрофильного присоединения и замещения. Активность мезо-положения.
•Фенантрен. Номенклатура, строение, ароматичность (в сравнении с бензолом и нафталином). Реакции окисления, восстановления, электрофильного замещения и присоединения.
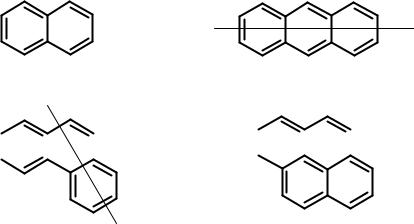
Конденсированные ароматические углеводороды
Полициклические ароматические соединения могут быть линеарными, ангулярными или перициклическими.
|
нафталин |
антрацен (линеарный) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
фенантрен (ангулярный) |
пирен (пери) |
Полициклические соединения выделяют из каменноугольной смолы. Очень многие из них обладают выраженным канцерогенным действием. Причем, чем больше циклов в соединении, тем вероятнее канцерогенность.
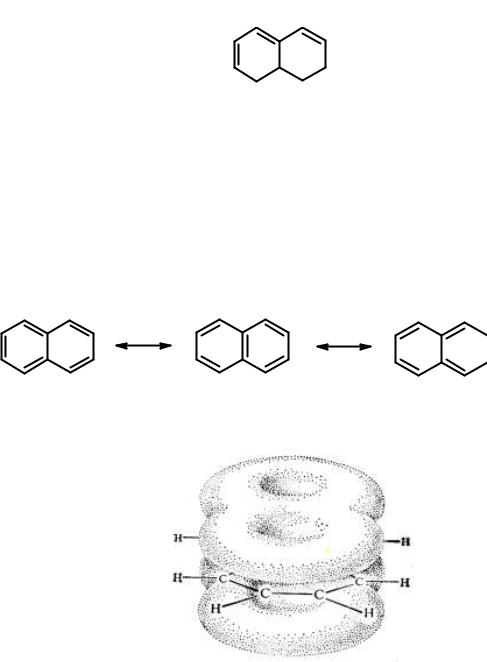
Нафталин
Нафталин - простейшее бициклическое ароматическое соединение.
129
8 |
1 (α) |
|
|
7 |
|
2 (β) |
|
|
|||
6 
 3
3
54
Хотя молекулярная формула указывает на ненасыщенный характер нафталина, его свойства типичны для ароматических соединений. Нафталин удовлетворяет структурным критериям ароматичности. Циклическая плоская система, имеющая непрерывную цепь сопряжения, в котором участвую 10 π- электронов. Следует помнить, что Хюккель формулировал свое правило для моноциклических систем. В случае нафталина считают, что в каждом цикле находится по 6 делокализованных электронов, а одна из пар является общей для обоих колец. Сопряжение показывают с помощью канонических структур:



 ...
...
В результате выше и ниже плоскости циклов находятся π-электронные облака, имеющие форму «восьмерки» (рис. 30):
Рис. 30. Форма π-электронных облаков молекулы нафталина
Внафталине не все С-С связи одинаковы. Так, длина С1-С2 равна 1,365 Å,
аС2-С3 – 1,404 Å. Энергия сопряжения нафталина 61 ккал/моль, что меньше удвоенной энергии делокализации бензола (2 х 36 ккал/моль). Вклад второго цикла в сопряжение меньше, чем первого. Нафталин менее ароматичен, чем бензол. Нарушение ароматичности одного из его циклов требует всего 25 ккал/моль, что и проявляется в его реакциях.
Реакции
Окисление нафталина протекает аналогично окислению бензола.
130
