
Термодинамика процессов термической деструкции
Направление высокотемпературных процессов и набор их продуктов в заметной мере определяется реакциями термической деструкции исходных веществ. Такие реакции в своем большинстве оказываются обратимыми. Направление их определяется составом исходных веществ, температурой и давлением процесса. Зная состав сырья, можно оценить равновесный состав реакционной смеси в заданной области температур и давлений, или по заданному набору продуктов найти температуры и давления, при которых его можно достичь. Подобные оценки выполняются с помощью термодинамических расчетов. Они могут проводиться для газофазных, жидкофазных и твердофазных процессов.
Изобарно-изотермический потенциал DG реакции ‑ функция температуры, а потому направление и конверсия обратимых реакций сильно меняются в различных температурных интервалах. Соответственно, меняется и состав конечных продуктов. Это относится к процессам формирования и переработки всего разнообразия горючих ископаемых, а также получения углеродных материалов.
Образование конденсированных углеродных структур сопровождается потерей исходными веществами легких углеводородных и гетероатомных соединений. Изобарно-изотермический потенциал модельных соединений, участвующих в подобных реакциях, изменяется с ростом температуры так, как это представлено на рис.1.

Из этих данных следует, что в области относительно низких температур термодинамически наиболее стабильны легкие предельные углеводородные газы. Менее устойчивы олефины, нафтены и арены. В более высокотемпературной области стабильны углерод и водород, несколько менее арены, метан и олефины. Наибольшим запасом энергии обладают парафины и нафтены. При равном числе атомов углерода в молекуле ряд термодинамической устойчивости веществ при температурах до 400 оС таков:
парафины>нафтены>олефины>арены.
При увеличении температуры это соотношение постепенно меняется. При температурах, превышающих 700 оС, оно оказывается противоположным:
арены>олефины>нафтены>парафины.
В свою очередь, для ароматических соединений при 0 оС с ростом конденсированности запас свободной энергии на 1 моль углерода уменьшается (рис. 2):
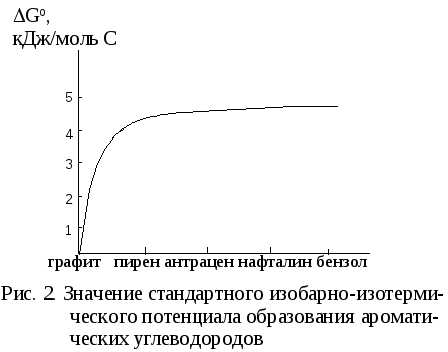
Следовательно, чем выше степень конденсированности, тем более термодинамически устойчиво соединение.
Таким образом, с ростом температуры высокомолекулярные органические соединения будут разлагаться с образованием стабильных легких углеводородных газов (метана, этилена), водорода, высококонденсированных ароматических веществ и твердого остатка со значительной долей графитоподобных образований. Достаточно длинные парафиновые цепочки будут подвергаться деструкции, нафтеновые циклы ‑ деструкции и ароматизации.
Энергии разрыва связей в органическом веществе
Термодинамические потенциалы ‑ характеристика статики процесса, его начального и конечного состояния, но не путей и скорости перехода от исходных веществ к продуктам. Регулирование скорости такого перехода определяется фактически энергией активации реакции. В простейших случаях деструкции связей - это энергия, которую надо сообщить молекуле, чтобы произошел разрыв связи. Естественно, чем прочнее связь, тем бóльшая энергия требуется для ее разрыва.
Как правило, энергии связей углерод-гетероатом ниже, чем связей углерод-углерод и углерод-водород (табл. 1).
Таблица 1
Энергии разрыва некоторых химических связей
-
Связь
Соединения
Энергия разрыва
связи, кДж/моль
С‑С
парафины
332
С=С
олефины
588
СºС
ацетиленовые
823
С‑С
нафтены
385
С‑С
ароматические
610
Сар‑Салк
С6Н5-СН3
384
С‑Н
парафины
413
Сар‑Н
ароматические
434
С‑СООН
кислоты
230
С‑S
сульфиды
138
Сар‑ОН
фенолы
293
С‑О
эфиры
376
С‑N
амины
334
Из сравнения энергий связи следует, что в первую очередь будут разрываться связи углерод-гетероатом с выделением летучих гетеросоединений (СО2, Н2S, H2O, NH3 и др.), а затем будут распадаться соединения, содержащие связи С‑С и С‑Н, причем в случае парафинов менее прочны связи углерод-углерод, а у аренов углерод-водород. Продукты радикальной термической деструкции по связям С‑С стабилизируются за счет образования более легкого парафина и олефина:
СН3-СН2-СН2-СН3 ® 2СН3-СН2· ® СН3-СН3 + СН2=СН2,
а по связи С‑Н ароматического соединения - за счет конденсации ядер:
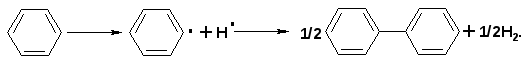
Таким образом, соотношение энергий активации реакций деструкции связей так же способствует образованию низкомолекулярных летучих веществ и высокомолекулярных ароматических систем, как и термодинамические характеристики этих процессов.
