
- •Оглавление
- •Введение
- •1. Химическая кинетика
- •1.1. Стехиометрия и материальный баланс в химических реакциях
- •Пример 1
- •Результаты анализа реакционной массы
- •Решение
- •Пример 2
- •Концентрации реагентов в реакционной массе (моль/л)
- •Решение
- •1.2. Скорость гомогенной химической реакции
- •1.3. Методика кинетического исследования
- •1.4. Дифференциальный метод обработки данных
- •1.5. Интегральный метод обработки экспериментальных данных
- •2. Кинетическое моделирование и механизм химической реакции
- •2.1. Классификация элементарных реакций
- •Обозначения бимолекулярных реакций
- •2.2. Построение кинетических моделей последовательности элементарных стадий
- •Метод стационарных концентраций Боденштейна-Семенова
- •Метод квазиравновесия
- •2.2.1. Цепные реакции
- •Зарождение цепи
- •Продолжение цепи
- •Обрыв цепи
- •Кинетика цепных реакций
- •Разветвленные цепные реакции
- •2.2.2. Гомогенный катализ
- •Нуклеофильный катализ
- •Кинетика нуклеофильного катализа
- •Комплексообразование «реагент – реагент»
- •Кислотно-основный катализ
- •Металлокомплексный катализ
- •2.2.3. Основы кинетики образования полимеров
- •Заключение
- •Рекомендательный список литературы
2. Кинетическое моделирование и механизм химической реакции
Построение кинетических моделей химических реакций может быть существенно облегчено, если имеются сведения о механизме химических реакций, полученные по литературным данным или по данным физико-химического анализа. С другой стороны, кинетические модели, построенные путем установления экспериментальной зависимости скорости реакции от концентраций реагентов, часто оказываются незаменимыми при выборе гипотезы о механизме реакции. Рассмотрим, каким образом можно построить кинетическую модель реакции, предполагая последовательность элементарных стадий, образующих ее механизм.
В общем случае речь должна идти о системе последовательно-параллельных элементарных реакций, в которых участвуют как стабильные, так и нестабильные частицы. Число типов элементарных стадий невелико. Они подразделяются на группы, отличающиеся количеством участников взаимодействия и способом разрыва старых связей и образования новых. Рассмотрим эти основные типы.
2.1. Классификация элементарных реакций
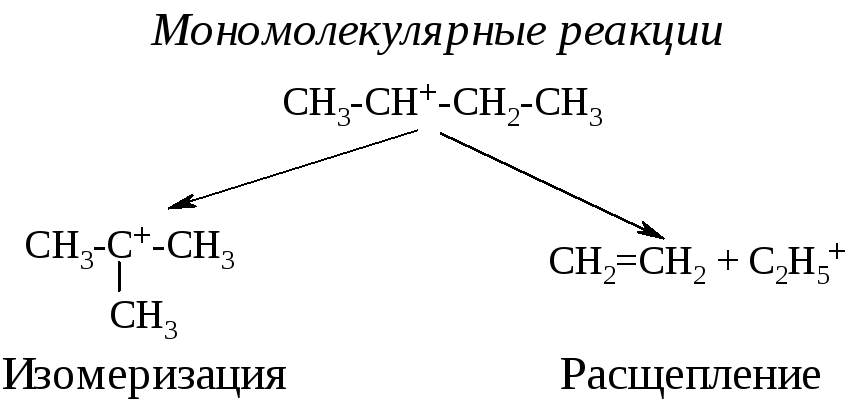
По числу участников взаимодействия реакции делятся на мономолекулярные и бимолекулярные. В некоторых источниках предполагается существование и тримолекулярных реакций. В мономолекулярных реакциях участвует одна частица (не обязательно молекула), которая претерпевает реакции либо изомеризации, либо расщепления. В случае расщепления электронная пара разрывающейся связи может быть разделена между группами, на которые разрывается исходная молекула (гомолитический разрыв), или оставаться локализованной у одного из атомов, соединенных этой связью (гетеролитический разрыв). В первом случае образуются незаряженные частицы (радикалы), во втором – заряженные (катион и анион). Примерами могут служить следующие реакции:

В бимолекулярных реакциях взаимодействуют две частицы. Эти взаимодействия сводятся к присоединению и замещению участников реакции. Реагентами могут быть две молекулы, два радикала, анион и катион, а также молекула и радикал или заряженная частица. В последнем случае считают, что молекула является неактивным, а нестабильная частица – активным (атакующим) реагентом. Более сложен выбор активного реагента, если они оба – молекулы. В этом случае атакующим реагентом считают тот, у которого наблюдается более ярко выраженный избыток или недостаток электронной плотности на атоме реакционного центра. По распределению электронной плотности на активном центре бимолекулярные реакции делятся на радикальные, нуклеофильные и электрофильные.
Разработана система обозначений основных типов бимолекулярных реакций, приведенная ниже (табл. 4):
Таблица 4
Обозначения бимолекулярных реакций
-
Тип реакции
Обозначение
Вид активной частицы
Индекс
Присоединение
Ad
–
–
Радикал
R
Замещение
S
Нуклеофил
N
Электрофил
E
Примеры обозначений: SN (нуклеофильное замещение), AdR (радикальное присоединение), SE (электрофильное замещение).
Радикалы – частицы с неспаренным электроном, они не несут на реакционном центре заряда, но стабильными при этом не являются, например: С6Н5СН2•, Cl•, CН3С•=О и др. Поскольку радикалы обладают слабым дефицитом электронов, они преимущественно атакуют реакционный центр второго реагента с повышенной электронной плотностью, но их избирательность по этому признаку не очень велика.
Нуклеофилы – анионы или молекулы, несущие максимум электронной плотности (свободную электронную пару) на активном центре, например Cl–, Br–, C2H5O–, HO–, Н2О:, RÖН, :NH3 и т.п. Нуклеофильной атаке подвержены реакционные центры с минимумом электронной плотности или с частичным положительным зарядом.
Электрофилы – катионы или молекулы, несущие минимум электронной плотности (свободную электронную орбиталь) на активном центре, например СН3–СН+–СН3, Со3+, BF3, H3O+. Они атакуют в молекуле реакционные центры с избытком электронной плотности (несущие частичный отрицательный заряд).
Рассмотрим ряд примеров, которые демонстрируют разнообразие бимолекулярных реакций.
|
Нуклеофильные реакции | |
|
Замещение SN
|
Присоединение AdN
|
|
Электрофильные реакции | |
|
Замещение SЕ
|
Присоединение AdЕ
|
|
| |
|
Замещение SR
|
Присоединение AdR
|
Часто выбор активной частицы, по которой можно определить тип реакции, оказывается неочевидным. Например, в случае реакций этерификации трудно установить, какой из реагентов надо считать атакующим:
СН3СООН + С2Н5ОН СН3СООС2Н5 + Н2О

Следует заметить также, что многие бимолекулярные реакции были отнесены к тому или иному типу прежде, чем выяснилась их сложная природа. Например, в реакциях нуклеофильного замещения, кинетика которых отвечает суммарному первому порядку, участвуют две молекулы реагентов. Следовательно, они не являются элементарными. Действительно, такие процессы протекают как двухстадийные: сначала происходит медленная обратимая диссоциация реагента на карбокатион и анион, а затем катион быстро взаимодействует со вторым реагентом, например гидролиз третичного бутилбромида в присутствии сильной щелочи происходит следующим образом:

В таком случае реакция должна рассматриваться не как бимолекулярное нуклеофильное замещение, а как мономолекулярное расщепление с последующим бимолекулярным присоединением. То же относится и к приведенной в примерах реакции электрофильного замещения атома водорода ароматического цикла на карбокатион SE. Эта реакция протекает через промежуточное образование - и -комплексов:

т.е. на самом деле это последовательность элементарных реакций бимолекулярного электрофильного присоединения (1), мономолекулярных изомеризации (2) и расщепления (3).






