- •Оглавление
- •Введение
- •1. Химическая кинетика
- •1.1. Стехиометрия и материальный баланс в химических реакциях
- •Пример 1
- •Результаты анализа реакционной массы
- •Решение
- •Пример 2
- •Концентрации реагентов в реакционной массе (моль/л)
- •Решение
- •1.2. Скорость гомогенной химической реакции
- •1.3. Методика кинетического исследования
- •1.4. Дифференциальный метод обработки данных
- •1.5. Интегральный метод обработки экспериментальных данных
- •2. Кинетическое моделирование и механизм химической реакции
- •2.1. Классификация элементарных реакций
- •Обозначения бимолекулярных реакций
- •2.2. Построение кинетических моделей последовательности элементарных стадий
- •Метод стационарных концентраций Боденштейна-Семенова
- •Метод квазиравновесия
- •2.2.1. Цепные реакции
- •Зарождение цепи
- •Продолжение цепи
- •Обрыв цепи
- •Кинетика цепных реакций
- •Разветвленные цепные реакции
- •2.2.2. Гомогенный катализ
- •Нуклеофильный катализ
- •Кинетика нуклеофильного катализа
- •Комплексообразование «реагент – реагент»
- •Кислотно-основный катализ
- •Металлокомплексный катализ
- •2.2.3. Основы кинетики образования полимеров
- •Заключение
- •Рекомендательный список литературы
Металлокомплексный катализ
Активация реагентов при металлокомплексном катализе осуществляется за счет взаимодействия с соединениями металлов (как правило, переходных). Чаще всего такое взаимодействие включает стадию образования промежуточного комплекса с участием d-орбиталей металла. Обычно превращения реагентов или их активация происходят в координационной сфере металла-катализатора. Основные особенности, отличающие металлокомплексный катализ от прочих областей гомогенного катализа, это многостадийность схем механизмов и большое количество комплексов, образующихся в течение процессов. Комплексы, центральным ионом которых является ион переходного металла, в качестве лигандов могут включать молекулы всех реагентов и продуктов реакции, а также промежуточные нестабильные частицы. Каждый из этих комплексов может в той или иной степени ускорять реакцию или, напротив, дезактивировать катализатор.
Рассмотрим ряд наиболее часто встречающихся механизмов металлокомплексного катализа.
Диссоциация, присоединение и замещение лигандов
диссоциация молекулы соли металла с выделением активированной молекулы лиганда, в дальнейшем выступающей как реагент МХ М + Х:
Fe0(CO)5 Fe0(CO)4 + CO;
введение молекулы реагента Y в координационную сферу металла M за счет обмена с молекулой растворителя S, занимающей координационное место

где L – лиганд.
При протекающей в уксусной кислоте (НОАс) реакции ацетата трехвалентного кобальта с бензальдегидом образуется комплекс:

обмен лиганда на молекулу реагента (другой лиганд) в координационной сфере металла LnMX + Y LnMY + X:
Со2+(OAc)24HOAc
+ Br–![]() Со2+(OAc)Br–
4HOAc
+ OAc–.
Со2+(OAc)Br–
4HOAc
+ OAc–.
Этот
механизм может быть диссоциативным
(первая стадия – LnMX![]() LnM+
+ Х–
и далее LnM+
+ Y–
LnMY)
и ассоциативным (через переходное
состояние YLnMX).
В первом случае кинетика процесса
подчиняется закону первого порядка r
= k[LnMX],
во втором – второго порядка r
= k[LnMX][Y].
LnM+
+ Х–
и далее LnM+
+ Y–
LnMY)
и ассоциативным (через переходное
состояние YLnMX).
В первом случае кинетика процесса
подчиняется закону первого порядка r
= k[LnMX],
во втором – второго порядка r
= k[LnMX][Y].
Перенос электрона
Процесс может происходить с участием двух комплексов металлов или как перенос электрона между ионом металла и органической молекулой. В данном случае можно говорить о реакциях окисления-восстановления. Если он осуществляется между двумя центральными ионами через общий лиганд , то говорят о внутрисферном переносе, если общий лиганд отсутствует, то – о внешнесферном:
внешнесферный перенос электрона
M12+Ln + M23+Lm Ln M12+M23+Lm M13+Ln + M22+Lm
Со3+(OAc)3 + Mn2+(OAc)2 [Со2+(OAc)3]– + [Mn3+(OAc)2]+
или
-
Co3+ + C6H5–CH3

Co2+ + (C6H5–CH3)+
внутрисферный перенос
YM13+Lm + M22+Ln M13+Lm Y M22+Ln YM12+Lm + M23+Ln
Co3+Cl– + Cr2+ Co3+ClCr2+ Co2+Cl– + Cr3+
|
Co3+Br– + C6H5–CH3 |
|
Co2+Br– + (C6H5–CH3)+ |
В результате частичного или полного переноса электрона реагент активируется.
Диссоциативная координация молекул X–Y с разрывом -связи
В данном случае происходит разрыв связи в молекуле исходного вещества, что приводит к образованию активных частиц, которые могут оставаться в координационной сфере металла. Эти реакции происходят с изменением степени окисления центрального иона или без него.
окислительное присоединение
-

LmM+(n+2)(X–)(Y–)
Такое присоединение возможно, если ион металла может изменить валентность на две единицы. При этом молекула реагента превращается в два аниона:
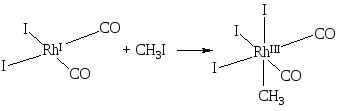
гомолитическое присоединение. Такое присоединение происходит с участием двух атомов металлов (атомы могут входить и в один биядерный комплекс). Молекула реагента претерпевает гомолитический разрыв ковалентной связи, образующиеся лиганды входят в координационную сферу центрального иона:
2M+nLm + X–Y M+(n+1)XLm + M+(n+1)YLm,
примером может служить реакция октакарбонила кобальта с водородом:
Со20(СО)8 + Н2 2СоI(СО)4Н;
гетеролитическое присоединение, происходящее с заменой лиганда в координационной сфере металла. Валентность металла при этом не изменяется:
Mn+Lm + X–Y Mn+Lm–1X + Y+ +L–, например:
RuIIICl63+ + H2 RuIIICl5H3++ H+ +Cl–
Внедрение по связи M–L в координационной сфере металла
В этом случае перестройка связей происходит в молекуле одного из лигандов, находящегося в координационной сфере центрального иона:
[Mn+Lm(XY)] LmМ–X–Y,
например:

Внешняя нуклеофильная или электрофильная атака лиганда реагентом из реакционной массы:
LmМ–X + :YH [LmМ–X–Y]– + H+;

Известны и другие механизмы металлокомлексного катализа, которые мы не будем рассматривать. Даже из приведенного ограниченного числа примеров видно разнообразие взаимодействия каталитического комплекса с реагентами. Из них следует, что практически всегда активация реагентов с участием металла-катализатора связана с изменениями в координационной сфере центрального иона.
Реакции металлокомплексного катализа часто сопровождаются образованием полиядерных комплексов с участием нескольких ионов металла. Каталитическая активность таких комплексов, как правило, отличается от активности моноядерных. В состав комплексов могут входить ионы одного металла с равными зарядами, ионы одного металла в разных степенях окисления и ионы разных металлов, например:
Mn3+
+ Mn3+![]() Mn3+Mn3+;
Mn3+Mn3+;
Co3+Br–
+ Co2+![]() Co3+Br–Co2+
Co3+Br–Co2+![]() Co2+BrCo2+;
Co2+BrCo2+;
(CO)5Mn
+ Re(CO)5![]() (CO)5Mn...Re(CO)5.
(CO)5Mn...Re(CO)5.
Кинетика металлокомплексного катализа
Рассмотрим простую реакцию присоединения А + Y B, катализируемую соединением переходного металла M в среде растворителя S. В условиях реакции возможно образование комплексов с реагентами
A
+ M![]() X1,
Y + M
X1,
Y + M![]() X2,
X2,
продуктом реакции
B
+ M![]() X3,
X3,
и растворителем
S
+ M![]() X4.
X4.
Концентрация любого реагента намного превышает концентрацию катализатора. Общая концентрация катализатора в растворе является суммой концентраций всех комплексов и концентрации металла М, не входящего ни в один из них:
сМ = [M]+[X1]+[X2]+[X3]+[X4].
Если равновесные концентрации комплексов устанавливаются достаточно быстро, а скорости их расходования малы, то можно воспользоваться принципом квазиравновесия и записать:
сМ = [M]+К1[M][А]+К2[M][Y]+К3[M][B]+К4[M][S]
или
сМ = [M](1+К1[А]+ К2[Y]+К3[B]+К4[S]),
откуда концентрация свободной формы металла
![]()
Отношение
![]()
называется функцией закомплексованности. Она меняется в пределах от 1 (при отсутствии комплексообразования сМ=[M]) до (при практически полностью связанном в комплексы металле [M]0). В лигандную сферу атома металла может входить несколько молекул реагентов, в том числе и различных. Рассмотрим схему механизма реакции, включающую последовательный ввод реагентов в координационную сферу металла, превращение комплекса в продукт и равновесное образование каталитически неактивного комплекса с растворителем.

Скорость накопления продукта В будет определяться скоростью распада комплекса Х2.
Сделаем следующие упрощения: равновесия устанавливаются быстро, концентрация реагента А будет намного меньше концентрации реагента Y, а концентрация М меньше, чем концентрации любого из остальных участников процесса: cY,0>>cA,0, cM<<cA,0, cY,0, cS. Тогда cA=[A], cY=[Y]=cY,0, cS=[S]. Скорость реакции равна
![]()
где, в соответствии с методом квазиравновесия,
[Х2]=К2[Х1][Y]=К1К2[М][A][Y].
Общая концентрация металла
сМ = [M]+[X1]+[X2]+[МS]
или
сМ = [M]+К1[M][А]+К2[X1][Y]+К4[M][S],
где [X2]=К2[X1][Y]=K1K2[M][A][Y].
С учетом сделанных допущений,
сМ=[M](1+К1сА+К2К1сАсY,0+K4cS),
откуда
![]()
Теперь
![]()
Разделив числитель и знаменатель на величину К1+К2К1сY,0, получим

где
![]()
Уравнение, записанное в представленной форме
![]() ,
,
носит
название уравнения
Михаэлиса-Ментен.
Параметры уравнения k
и К можно определить, представив
экспериментальные данные в виде
![]() Это уравнение прямой линии, отсекающей
на оси ординат отрезок 1/k
с тангенсом угла наклона, равным К/k.
Константы комплексообразования К1,
К2,
К4
и константу скорости k3
можно определить по зависимостям k
и К от концентраций реагента Y,
катализатора и растворителя S.
Рассмотрим схему определения этих
констант.
Это уравнение прямой линии, отсекающей
на оси ординат отрезок 1/k
с тангенсом угла наклона, равным К/k.
Константы комплексообразования К1,
К2,
К4
и константу скорости k3
можно определить по зависимостям k
и К от концентраций реагента Y,
катализатора и растворителя S.
Рассмотрим схему определения этих
констант.
Установим зависимость k от начальной концентрации катализатора. Если наше предположение о форме их функциональной связи верно, то график в координатах k – сМ окажется прямой линией, проходящей через начало координат y=bx (рис. 8).
|
|
Рис. 8. Зависимость константы уравнения Михаэлиса-Ментен от концентрации катализатора |
Тангенс
угла наклона представляет собой следующее
выражение:
![]() имеющее размерность константы скорости
второго порядка.
имеющее размерность константы скорости
второго порядка.
|
|
|
|
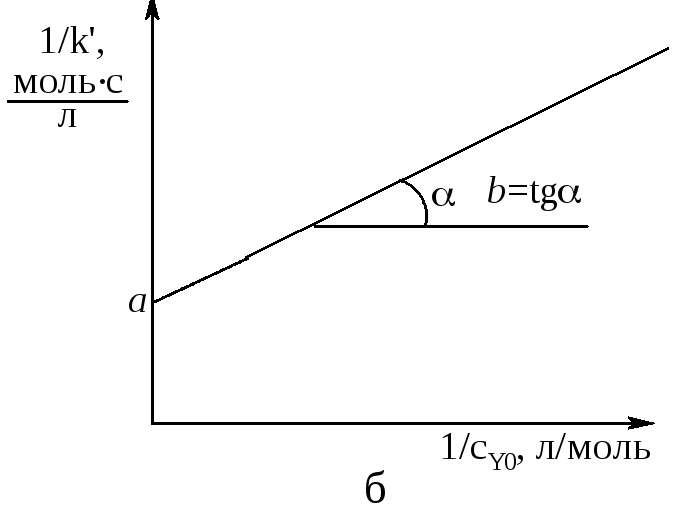
Рис. 9. Зависимость константы k от концентрации реагента, находящегося в избытке (а) и линеаризация этой зависимости (б) | |
Эта зависимость имеет вид дробно-линейной функции (рис. 9,а), спрямляющейся в координатах y=а+bx, где y=1/k, х=1/сY0, и a=1/k3, b=1/(k3K2). Отсюда k3=1/а; К2=1/(k3b)=а/b. Таким образом по зависимости k от сМ и сY0 установлены значения двух констант кинетического уравнения k3 и K2. Константы комплексообразования К1 и К4 найдем по изменению величины К при разных концентрациях растворителя S. С этой целью запишем выражение для К в следующем виде:
![]()
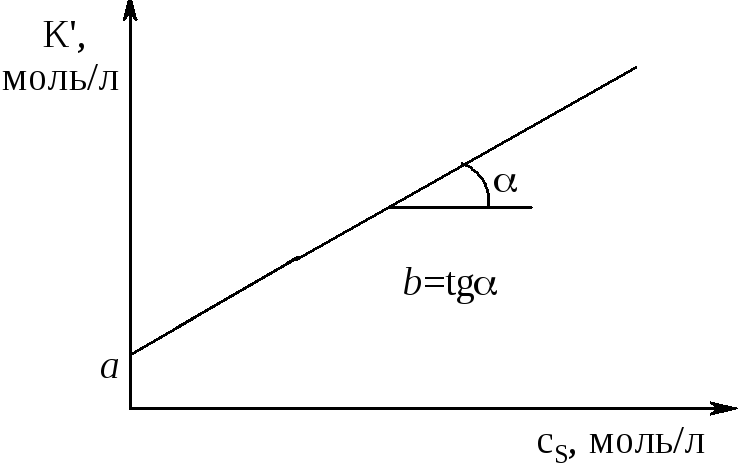
Для построения этой зависимости вводим величину К Это уравнение прямой линии, не проходящей через начало координат (рис. 10) y=а+bx.
|
|
Рис. 10. Зависимость произведения К(1+К2сY0) от концентрации лиганда S |
В данном случае а=1/К1, b=К4/К1, откуда К1=1/а, К4=К1b= b/а. Следовательно, установлены все неизвестные константы уравнения Михаэлиса. Очевидно, что возможны и другие пути определения величин констант скорости и комплексообразования исходя из имеющегося эксперимента.
Рассмотрим ряд более простых, типичных для металлокомплексного катализа механизмов.
Образование активного комплекса Х1 катализатора с одним из реагентов, при его взаимодействии со вторым реагентом получается продукт реакции:

[X1]=K1[M][A]: cM=[X1]+[M]=K1[M][A]+[M]=[M](1+K1[A]);
![]()
Зависимость скорости реакции от концентрации реагента А имеет дробно-линейный характер. При низких концентрациях А (сА<<1) порядок по А сводится к первому, так как К1сА<<1 и rB=k2K1cMcAcY. При высоких А (сА>>1) порядок оказывается нулевым (rB=k2cMcY). От концентраций второго реагента и катализатора скорость реакции зависит линейно.
Образование активного комплекса Х1 катализатора с одним из реагентов, при его взаимодействии со вторым реагентом получается продукт реакции В. Продукт связывает катализатор в неактивный комплекс Х2:

[X1]=K1[M][A]; [X2]=K3[M][B]; cM=[M]+[X1]+[X2]=[M](1+K1[A]+K3[B]).
![]()
Из соотношений материального баланса сВ=сА,0–сА. Тогда
![]()
При избытке Y и K1>K3 имеем
![]()
где
![]() ,
,
при K1<K3
![]()
где
![]() .
.
Образование активного комплекса Х1 катализатора с одним из реагентов, при его взаимодействии со вторым реагентом получается продукт реакции В. При димеризации молекул катализатора образуется неактивный комплекс Х2:

[X1]=K1[M][A]; [X2]=K3[M]2.
cM=[M]+[X1]+2[X2]=[M]+K1[M][A]+2K3[M]2, или
2K3[M]2+[M](1+ K1[A])–сМ=0.
Это квадратное уравнение с положительным корнем, равным
![]()
Скорость накопления продукта будет равна
rB=k2[X1]cY= k2K1[M]cAcY или
![]()