
- •Оглавление
- •Введение
- •1. Химическая кинетика
- •1.1. Стехиометрия и материальный баланс в химических реакциях
- •Пример 1
- •Результаты анализа реакционной массы
- •Решение
- •Пример 2
- •Концентрации реагентов в реакционной массе (моль/л)
- •Решение
- •1.2. Скорость гомогенной химической реакции
- •1.3. Методика кинетического исследования
- •1.4. Дифференциальный метод обработки данных
- •1.5. Интегральный метод обработки экспериментальных данных
- •2. Кинетическое моделирование и механизм химической реакции
- •2.1. Классификация элементарных реакций
- •Обозначения бимолекулярных реакций
- •2.2. Построение кинетических моделей последовательности элементарных стадий
- •Метод стационарных концентраций Боденштейна-Семенова
- •Метод квазиравновесия
- •2.2.1. Цепные реакции
- •Зарождение цепи
- •Продолжение цепи
- •Обрыв цепи
- •Кинетика цепных реакций
- •Разветвленные цепные реакции
- •2.2.2. Гомогенный катализ
- •Нуклеофильный катализ
- •Кинетика нуклеофильного катализа
- •Комплексообразование «реагент – реагент»
- •Кислотно-основный катализ
- •Металлокомплексный катализ
- •2.2.3. Основы кинетики образования полимеров
- •Заключение
- •Рекомендательный список литературы
Кислотно-основный катализ
Такой катализ осуществляется посредством кислот и оснований. Принципиально схема кислотно-основного катализа не отличается от нуклеофильного, но есть и достаточно существенные различия. Они, в основном, связаны с тем, что протонные кислоты и основания находятся в растворах в разных формах, которые в той или иной степени участвуют в катализе. Рассмотрим механизм такого катализа на примере кислотного.
Одноосновная протонная кислота, находящаяся в реакционной массе, обменивается протоном с растворителем по равновесной реакции:
HZ
+ SH![]() Z
+ SH2+,
Z
+ SH2+,
где HZ – кислота; SH – растворитель; Z– – сопряженное основание кислоты; SH2+ – ион лиония.
Константа этого равновесия представляет собой константу диссоциации кислоты
![]() ,
,
а
отношение концентрации протонов к общей
концентрации катализатора (сК)
 носит названиестепени
диссоциации.
носит названиестепени
диссоциации.
Когда
кислотный катализ осуществляется
одновременно ионом лиония, недиссоциированными
формами кислоты и растворителя, то
говорят об общем кислотном катализе.
Если катализатором является только
SH2+,
то речь идет о специфическом кислотном
катализе. Активация одного из исходных
веществ происходит за счет передачи
протона реагенту или за счет образования
комплекса реагента с недиссоциированной
формой катализатора или растворителя.
Эти процессы обычно протекают как быстро
устанавливающиеся равновесия.
Активированная форма реагента медленно
взаимодействует со вторым участником
процесса. Для реакции
![]() рассмотрим схему общего кислотного
катализа:
рассмотрим схему общего кислотного
катализа:

Скорость образования продукта можно записать следующим образом:
rВ = k1[A...HZ][Y] + k2[AH+][Y] + k3[A...SH][Y].
Обычно скорости установления равновесий существенно превышают скорости образования продуктов, поэтому воспользуемся квазиравновесным методом:

и

Так как кислоту, как катализатор, добавляют в небольших количествах, то можно считать, что cSH = [SH] const и включить ее концентрацию в состав констант:
![]()
Степень диссоциации кислоты определяется выражением
![]() и
[SH2+]
= KcHZ;
[HZ]
= (1K)cHZ.
и
[SH2+]
= KcHZ;
[HZ]
= (1K)cHZ.
Тогда итоговое уравнение имеет следующий вид:
![]()
Степень диссоциации кислоты можно рассчитать, зная константу диссоциации (КС):
![]() или
или

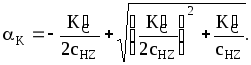
Рассмотрим частные случаи:
1) К1
![]()
2) К1
![]()
где kH1=k1K1cHZ+ k3K31; kH2=k2K21cHZ+ k3K31.
Если речь идет о специфическом кислотном катализе, то в итоговом уравнении остается только второе слагаемое и
![]()
где kH2=k2K21cHZ+KcHZ.
Зависимость наблюдаемых констант от концентрации кислоты представлена на рис. 7. Экспериментальную зависимость для К1 можно обосновать, используя уравнение, связывающее степень диссоциации слабой кислоты с ее концентрацией. Продифференцировав его по сHZ, можно проанализировать поведение степени диссоциации с возрастанием концентрации слабой кислоты:

C ростом сHZ (а при постоянной температуре КСconst) уменьшается знаменатель второго слагаемого и, соответственно, разность, стоящая в скобке. Кроме того, множитель перед скобкой также уменьшается с ростом концентрации кислоты. Все это приводит к тому, что с повышением сHZ наклон кривой сHZ уменьшается.
-


Рис. 7. Зависимость наблюдаемой константы от общей концентрации кислоты: а – при специфическом катализе, б – при общем катализе
Очевидно, в конкретном растворителе величина константы k1 не зависит от природы применяемой кислоты, а k2 меняется с заменой катализатора.
Аналогичные зависимости могут быть получены и для оснóвного катализа, только в системе будет осуществляться равновесие
HZ
+ SH![]() S–
+ ZH2+,
S–
+ ZH2+,
где HZ – основание; SH – растворитель; S– – ион лиата; ZH2+ – сопряженная кислота основания.
Общий основный катализ будет происходить за счет реакций с участием HZ, SH и S–, специфический – с участием только лиат-аниона.
