
Бх 33-36
.doc33.Глюконеогенез-локалізація,субстрати,ферм.реакції та фізіологічне значення процесу.Глюконеогенез (гліконеогенез) — синтез глюкози з невуглеводних метаболіч-них попередників, до яких належать: піруват (та лактат); деякі амінокислоти. певна кількість глюкози може утворюватися з гліцеролу та продуктів катаболізму жирних кислот.Реакції глюконеогенезу відбуваються переважно в печінці та, в деякій мірі, в кірковому шарі нирок, Біосинтезглюкози забезпечує її нормальну концентрацію в умовах зменшеного надходженнямоносахариду із зовнішнього середовища та вичерпання головного акумульова-ного джерела глюкози — глікогену печінки та м’язів.
Незворотними реакціями гліколізу є:
1) гексокіназна (або глюкокіназна) реакція:
глюкоза + АТФ =глюкозо-6-фосфат + АДФ
2) фосфофруктокіназна реакція:
фруктозо-6-фосфат + АТФ=фруктозо-1,6-дифосфат + АДФ
3) піруваткіназна реакція:
фосфоенолпіруват + АДФ =піруват + АТФ
, специфічні для глюконеогенезу реакції.
– перетворення глюкозо-6-фосфату в глюкозу;
– перетворення фруктозо-1,6-дифосфату в фруктозо-6-фосфат;
-перетворення пірувату в фосфоенолпіруват.
Реакції та ферменти глюконеогенезу
1. Перетворення пірувату в фосфо-
енолпіруват.
1). Перетворення пірувату в оксало-
ацетат (щавлевооцтову кислоту) за участю
ферменту піруваткарбоксилази:
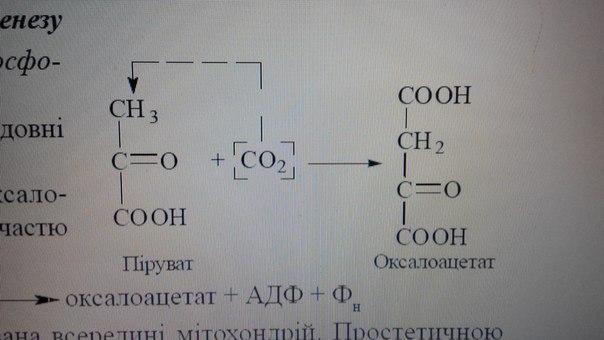
піруват + СО2 + АТФ=оксалоацетат + АДФ + Фн
Піруваткарбоксилаза локалізована всередині мітохондрій.
2). Перетворенняоксалоацетату в фосфоенолпіруват (ФЕП)за участю ферменту
фосфоенолпіруват-карбоксикінази (ФЕП-
кінази):
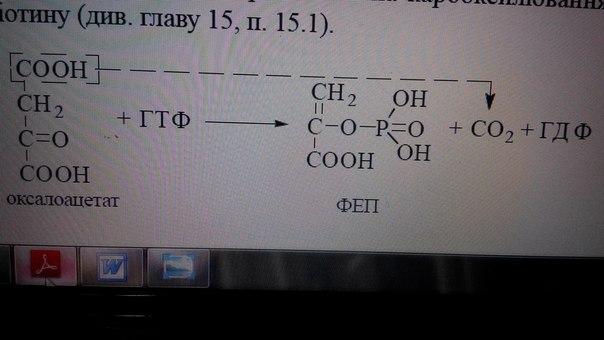
оксалоацетат + ГТФ = ФЕП + СО2 + ГДФ
У клітинах більшості тваринних організмів ФЕП-кіназа локалізована в
цитозолі, у людини — в цитозолі, частково — в мітохондріях.
2. Перетворення фруктозо-1,6-дифос-
фату в фруктозо-6-фосфат:
фруктозо-1,6-дифосфат + Н2О = фруктозо-6-фосфат + Фн
Реакція каталізується регуляторним ферментом фруктозо-1,6-дифосфатазою (Фр-1,6-дифосфатазою), що міститься в печінці (головним чином), а такожу нирках і епітеліоцитах кишечника.
3. Перетворення глюкозо-6-фосфату в глюкозу:
глюкозо-6-фосфат + Н2О = глюкоза + Фн
Реакція забезпечує шун-тування незворотної гексо-кіназної (глюкокіназної)
реакції гліколізу; каталізу-ється ферментом глюкозо-6-
фосфатазою (Г-6-Ф-азою),найбільш високий вмістякого — в мембранах ен-доплазматичного ретикулуму гепатоцитів.
Cубстрати глюконеогенезу
1. Утворення пірувату з лактату в печінці
Лактат, утворенний з пірувату в анаеробному гліколізі, є кінцевим продуктом
метаболізму
L-лактат + НАД+ =піруват + НАДН + Н+
Реакція каталізується лактатдегідрогеназою.
Сумарне рівняння
2 піруват + 4 АТФ + 2 ГТФ + 2 НАДН + 2 Н+ + 4 Н2О = глюкоза + 2 НАД+ + 4 АДФ + 2 ГДФ + 6 Фн
34.Регуляція гліколізу і глюконеогенезу дифосфат-2,6-фруктозою
На глюконеогенез впливають такі гормони, як глюкагон й інсулін підшлункової залози та глюкокортикоїди кори надниркових залоз. При голодуванні глюкагон посилює розпад жирів у жировій тканині. Жирні кислоти надходять у печінку, де розпадаються до ацетил-КоА. Швидкість окиснення ацетил-КоА в циклі лимонної кислоти відстає від швидкості його утворення, і підвищений рівень ацетил-КоА в клітині активує піруваткарбоксилазу. В результаті посилюється глюконеогенез.
Глюкагон започатковує глюконеогенез ще одним способом – через фруктозо-2,6-дифосфат. Утворюється фруктозо-2,6-дифосфат із фруктозо-6-фосфату при дії фосфофруктокінази ІІ, а розщеплюється фруктозо-2,6-дифосфатазою.
Фруктозо-2,6-дифосфат активує фермент гліколізу фосфофруктокіназу і гальмує активність ферменту глюконеогенезу фруктозо-1,6-дифосфатази. Утворення фруктозо-2,6-дифосфату пригнічується глюкагоном, який шляхом цАМФ-залежного фосфорилювання інактивує фосфофруктокіназу ІІ й активує фруктозо-2,6-дифосфатазу. Таким чином, при голодуванні глюкагон знижує внутрішньоклітинну концентрацію фруктозо-2,6-дифосфату, що викликає стимуляцію глюконеогенезу і гальмування гліколізу. Підвищення швидкості глюконеогенезу в печінці призводить до того, що глюкоза надходить у кров і потрапляє в інші органи, насамперед у мозок.
35.Розпад глікогену(глікогеноліз) в печінці та м”язах:ферм.реакції,енергетичний вихід та значення для організму.Регуляція активності глікогенфосфорилази.
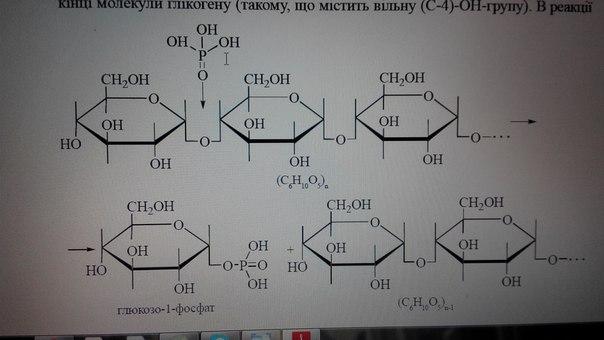
(С6Н10O5)n + Н3 РО4 =глюкозо-1-фосфат + (С6Н10О5)n-1
Фермент, що каталізує реакцію, — глікогенфосфорилаза.
2. Фосфорилаза відрізає моносахаридні залишки у вигляді глюкозо-1-фосфатувід нерозгалужених амілозних ланцюгів глікогену. Розщеплення розгалужених фрагментів відбувається під дією аміло-1,6-глікозидази (дерозгалужуючий фермент).
Фермент каталізує глікозилтрансферазну та аміло-1,6-глюкозидазну реакції,
а саме:
– переносить олігосахаридні залишки, що складаються із трьох моносахаридів, в кінець нерозгалужених ланцюгів, що експонує залишки глюкози,сполучені з основним ланцюгом (1,6)глікозидними зв’язками;
– розриває (1,6)-глікозидні зв’язки гідролітичним шляхом, вивільняючи
молекули глюкози.
3. Глюкозо-1-фосфат, що утворюється при фосфоролізі глікогену, під дією
фосфоглюкомутази перетворюється в глюкозо-6-
фосфат.
4. Подальші метаболічні шляхи обміну глюкозо-6-фосфату відмінні в клітинах печінки і м’язів:
– в печінці глюкозо-6-фосфат при дії глюкозо-6-фосфатази перетворюється у вільну глюкозу, яканадходить у кров і використовується в інших органах і тканинах;
– у м’язах, які не містять глюкозо-6-фосфатази,глюкозо-6-фосфат використовується для власних
енергетичних потреб, окислюючись аеробним або анаеробним шляхом.
Регуляція активності глікогенфосфорилази
Глікогенфосфорилаза печінки та м’язів — це димер, який містить у своєму складі
піридоксальфосфат. Фермент може перебувати в активній фосфорильованій формі(фосфорилаза а) та неактивній дефосфорильованій формі (фосфорилаза b).
1. Перетворення неактивної фосфорилази b в активну фосфорилазу a відбувається шляхом фосфорилювання серинових залишків у молекулі фосфорилази за рахунокмакроергічних зв’язків АТФ:
фосфорилаза b + 4АТФ =фосфорилаза a + 4АДФ
Дефосфорилювання фосфорилази a протеїнфосфатазою (фосфатазою)призводить до утворення неактивної фосфорилази b.
2. Фермент, що фосфорилює фосфорилазу b, — кіназа фосфорилази b. Кіназа
фосфорилази b також існує в двох молекулярних формах — неактивній та активній,
які взаємоперетворюються шляхом фосфорилювання — дефосфорилювання.
Фосфорилювання кінази фосфорилази b (КФ b) відбувається за участю АТФ
під дією цАМФ-залежної протеїнкінази:
цАМФ-залежна
протеїнкіназа
КФ b (неактивна) + АТФ=КФ b (активна) + АДФ
Дефосфорилювання кінази фосфорилази b фосфатазою супроводжується зво-
ротним переходом ферменту в неактивну форму.
3. Каталітично активна протеїнкіназа формується за умов її взаємодії з3',5'-АМФ (цАМФ), утворення якого в аденілатциклазній реакції є пусковою молекулярною подією, що включає каскадний механізм регуляції ферментних процесів у клітині.
А к т и в а ц і я аденілатциклази в гепатоцитах відбувається за умов взаємодії з мембранними ре-
цепторами гормону -клітин підшлункової залози глюкагону. В клітинах м’язів ферментний каскад
гл і ко ге н ол і зу включається при взаємодії з -адренорецепторами мембран міоцитів гормону моз-
кового шару надниркових залоз адреналіну (епінефрину).
36.Біосинтез глікогену:ферментативні реакції,значення для організму.Регуляція активності глікогенсинтази.
Ферментативні реакції синтезу глікогену (глікогенезу)
-
Утворення нуклеотидцукру-попередника.
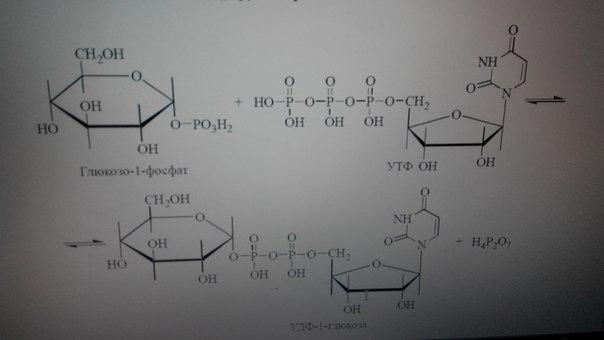
Реакція катазізується ферментом УДФ-глюкозопірофосфорилазою і є оберненою, але у фізіологічних умовах її рівновага зсунута праворуч у зв’язку з постійним гідролізом пірофосфату, що утворюється (Н4Р2О7), пірофосфатазою..Глюкозо-1-фосфат, який є субстратом реакції, утворюється з глюкозо-6-фосфату за рахунок дії фосфоглюкомутази.
2. Формування нерозгалужених ланцюгів глікогену.
При синтезі -1,4-глікозидних (амілозних) ланцюгів глікогену в ролі акцепторів активованих залишків глюкози виступають нерозгалужені полісахаридні ланцюги вже наявних у клітині молекул глікогену (“затравочний” глікоген). Фермент УДФ-глікогентрансфераза (глікогенсинтаза) переносить молекули моносахариду від УДФ-1-глюкози на С-4-гідроксильні групи термінальних (n-их)залишків глюкози
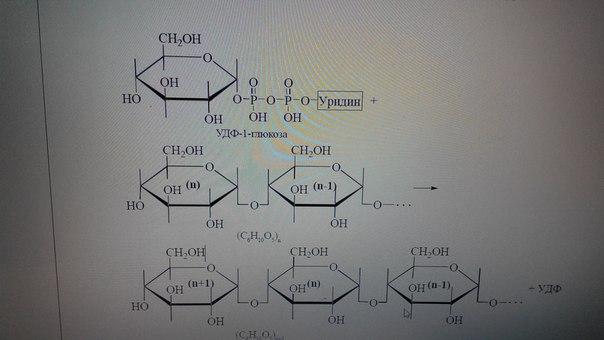
УДФ-1-глюкоза + (С6Н10О5)n=УДФ + (С6Н10О5)n+1
Регуляція активності глікогенсинтази
глікогенсинтаза може існувати в двох молекулярних формах — фосфорильованій і дефосфорильованій. Але, на відміну від глікогенфосфорилази, каталітично активною є дефосфорильована форма ферменту — глікогенсинтаза a, а неактивною — фосфорильована форма —глікогенсинтаза b.Фосфорилювання глікоген-синтази здійснюється за сериновими залишками фер-
менту цАМФ-залежною протеїнкіназою за рахунок макроергічних фосфатів АТФ:
глікогенсинтаза a + 2АТФ= глікогенсинтаза b + 2АДФ
(активна) (неактивна)
Зворотна реакція — дефосфорилювання (активація) глікоген-синтази ката-
лізується відповідною фосфатазою.
Із наведеного зрозуміло, що стимуляція каскаду фосфоролізу глікогену адреналіном або глюкагоном, яка супроводжується зростанням концентрації в клітинах цАМФ та активності цАМФ-залежних протеїнкіназ, призводить до фосфорилювання глікогенсинтази і її інактивації, тобто до пригнічення реакцій синтезу глікогену.Таким чином, глікогенфосфорилаза і глікогенсинтаза регулюються рецип-
рокно: активація глікогенфосфорилази (і фосфоролізу глікогену) відбу-
вається в умовах інактивації глікогенсинтази (і синтезу глікогену)
