
ХИМИЯ.Общие вопросы
.docx|
1)ДИСПЕРСНЫЕ
СИСТЕМЫ,
гетерогенные системы из двух или
большего числа фаз с сильно развитой
поверхностью раздела между ними.
Обычно одна из фаз образует
непрерывную дисперсионную
среду,
в объеме которой распределена дисперсная
фаза в
виде мелких кристаллов,
твердых аморфных частиц, капель или
пузырьков. Дисперсные системы могут
иметь и более сложное строение, например
представлять собой двухфазное
образование, каждая из фаз которого
проникает в объем другой фазы. К таким
системам относятся твердые
тела,
пронизанные разветвленной системой
каналов, заполненных газом или жидкостью.
Нередки случаи, когда дисперсионная
среда "вырождается"
до тончайших слоев (пленок), разделяющих
частицы дисперсной
фазы.
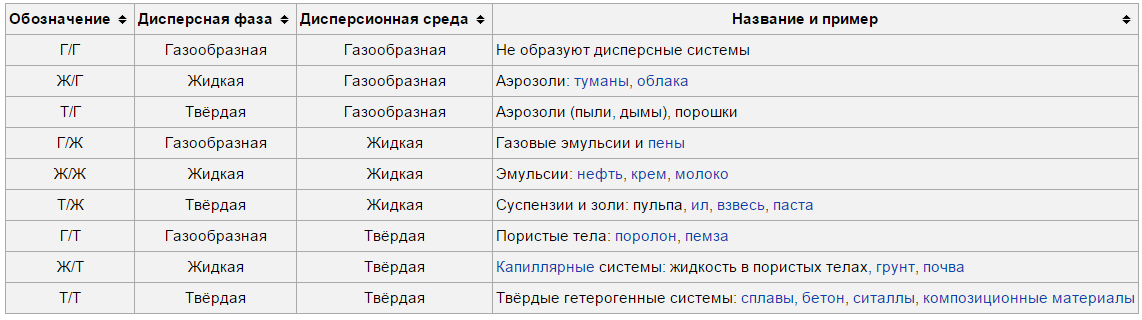
2)Типы
дисперсных систем.
|
|
|
|
|
|
6)Строение коллоидной частицы -Коллоидные частицы имеют сложное строение. Они состоят из ядер и адсорбированных и притянутых ионов. Рассмотрим строение коллоидной частицы кремниевой кислоты, которая образовалась в результате взаимодействия очень разбавленных растворов силиката натрия и соляной кислоты (Na2Si03 + 2HCl = H2Si03 + 2NaCl). Если Na2Si03 находится в избытке, то кремниевая кислота не выпадает в осадок, а образуется прозрачный коллоидный раствор H2Si03. Ядро коллоидной частицы нейтрально, оно состоит из m молекул H2Si03. На поверхности ядра адсорбируются n ионов Si032- , это потенциалопределяющие ионы, так как они обуславливают заряд частицы коллоидного раствора. Адсорбированные потенциалопределяющие ионы притягивают из раствора ионы противоположного знака — противоионы. В данном случае это ионы Na+, причем часть их 2(n - х) адсорбируется на частице. Адсорбированные ионы Si032- вместе с противоионами Na+ образуют адсорбционный слой. Другая часть противоионов 2xNa+ находится в жидкой фазе и образует подвижный диффузный слой. Ядро вместе с адсорбционным слоем называется гранулой. В нашем примере гранула заряжена отрицательно, так как адсорбция ионов Si032-происходит сильнее, чем ионов Na-. Коллоидная частица вместе с противоионами диффузионного слоя называется мицеллой. Это отдельная частица коллоидного раствора. Мицелла
(коллоидная частица)
|

 3)Коллоидные
растворы (др.-греч. κόλλα —
клей + εἶδος —
вид; «клеевидные») — дисперсные системы,
промежуточные между истинными
растворами и грубодисперсными системами — взвесями,
в которых дискретные частицы, капли
или пузырьки дисперсной фазы, имеющие
размер хотя бы в одном из измерений
от 1 до 100 нм,
распределены в дисперсионной среде,
обычно непрерывной, отличающейся от
первой по составу или агрегатному
состоянию. В свободнодисперсных коллоидных
системах (дымы, золи)
частицы не выпадают в осадок.
4)Свойства
коллоидных систем
:
4.1)Коллоидные
частицы не препятствуют прохождению
света.
4.2)В
прозрачных коллоидах наблюдается
рассеивание светового луча (эффект
Тиндаля).
4.3)Дисперсные
частицы не выпадают в осадок —
Броуновское движение поддерживает
их во взвешенном состоянии, но в отличие
от броуновского движения частиц,
дисперсные частицы в коллоидных
растворах не могут встретиться, что
обусловлено одинаковым зарядом
частиц.
5)Кинетическая
и агрегативная устойчивость коллоидных
систем:
Кинетическая
устойчивость —
способность коллоидов не
изменяться во времени при постоянных
условиях хранения (концентрация
раствора однородна
по всему объему системы). Иначе это
устойчивость коллоидных
систем к
оседанию. Определяется способностью
частиц к броуновскому
движению.
АГРЕГАТИВНАЯ
УСТОЙЧИВОСТЬ -
способность системы к сохранению
постоянной дисперсности. Для коллоидных
систем специфична агрегативная
неустойчивость, так как лиофобные
системы обладают большим запасом
свободной энергии на границе раздела
фаз, поэтому всегда возможен процесс
агрегации (слипания) частиц и уменьшение
общей поверхности дисперсной фазы.
Для придания агрегативной устойчивости
требуется введение стабилизатора.
3)Коллоидные
растворы (др.-греч. κόλλα —
клей + εἶδος —
вид; «клеевидные») — дисперсные системы,
промежуточные между истинными
растворами и грубодисперсными системами — взвесями,
в которых дискретные частицы, капли
или пузырьки дисперсной фазы, имеющие
размер хотя бы в одном из измерений
от 1 до 100 нм,
распределены в дисперсионной среде,
обычно непрерывной, отличающейся от
первой по составу или агрегатному
состоянию. В свободнодисперсных коллоидных
системах (дымы, золи)
частицы не выпадают в осадок.
4)Свойства
коллоидных систем
:
4.1)Коллоидные
частицы не препятствуют прохождению
света.
4.2)В
прозрачных коллоидах наблюдается
рассеивание светового луча (эффект
Тиндаля).
4.3)Дисперсные
частицы не выпадают в осадок —
Броуновское движение поддерживает
их во взвешенном состоянии, но в отличие
от броуновского движения частиц,
дисперсные частицы в коллоидных
растворах не могут встретиться, что
обусловлено одинаковым зарядом
частиц.
5)Кинетическая
и агрегативная устойчивость коллоидных
систем:
Кинетическая
устойчивость —
способность коллоидов не
изменяться во времени при постоянных
условиях хранения (концентрация
раствора однородна
по всему объему системы). Иначе это
устойчивость коллоидных
систем к
оседанию. Определяется способностью
частиц к броуновскому
движению.
АГРЕГАТИВНАЯ
УСТОЙЧИВОСТЬ -
способность системы к сохранению
постоянной дисперсности. Для коллоидных
систем специфична агрегативная
неустойчивость, так как лиофобные
системы обладают большим запасом
свободной энергии на границе раздела
фаз, поэтому всегда возможен процесс
агрегации (слипания) частиц и уменьшение
общей поверхности дисперсной фазы.
Для придания агрегативной устойчивости
требуется введение стабилизатора.