
- •2.4 . Зміни активності ферментів при захворюваннях серця та скелетних м’язів
- •5.3. Зміни активності ферментів при захворюваннях опорно-рухового апарата
- •5.4. Використання ферментів із діагностичною метою в нефрології та урології
- •Зміни активності ферментів при онкологічних захворюваннях
- •5.8. Використання ферментів із діагностичною метою в пульмонології
- •5.9. Використання ферментів із діагностичною метою в гематології
- •3.1 Біохімічні причини спадкових ензимопатій
2.1
. Використання ферментів у клінічній практиці
У клініці ферменти застосовуються для вирішення таких завдань:
установлення раннього діагнозу;
проведення диференціального діагнозу;
оцінювання динаміки перебігу захворювання;
визначення ефективності лікування;
оцінювання ступеня видужання;
із прогностичною метою.
Для ранньої діагностики ряду захворювань використання ферментів виявилося більш інформативним, ніж застосування інших біохімічних тестів. Так, зміна активності АлАТ, АсАТ, альдолази при інфекційному гепатиті виявляється значно раніше, ніж зміни таких біохімічних показників, як білірубін, тимолова проба, білкові фракції та ін. Підвищення активності ЛФ при рахіті, а КК та АсАТ – при інфаркті міокарда успішно використовується для ранньої діагностики цих захворювань.
Для ранньої діагностики захворювань при масових обстеженнях можна обмежитися декількома найчутливішими та найінформативнішими ферментними тестами. Наприклад, для виявлення вірусного гепатиту достатньо дослідити лише АлАТ, для виявлення отруєнь фосфорорганічними сполуками – холінестеразу, для встановлення носіїв у сім’ях хворих на прогресуючу м’язову дистрофію – КК.
Використання ферментів (АсАТ, АлАТ, ЛФ, ГГТП) для диференціальної діагностики, подібних за клінічними проявами механічної та паренхіматозної жовтяниць, значно покращило діагностичні можливості.
Використання органоспецифічних ферментів та ізоферментів є одним із вирішальних критеріїв при встановленні діагнозу. Прикладом може бути використання СДГ для розмежування печінкової та обтураційної жовтяниць, КК та АсАТ – для диференціації інфаркту міокарда і стенокардії.
Ферменти є надійними критеріями, здатними характеризувати період захворювання (гострий, хронічний). Часто активність ферментів змінюється до прояву клінічних ознак загострення хвороби, наприклад, підвищення АлАТ передує збільшенню вмісту білірубіну, погіршенню самопочуття хворого.
Ферменти успішно використовують в клінічній практиці для оцінки ефективності лікування, ступеня виздоровлення, прогнозу. Відсутність зміни активності ферментів на фоні застосування лікарських препаратів та інших методів лікування свідчить про їх низьку ефективність. При оцінці ступеня виздоровлення ферменти виявилися більш інформативними показниками порівняно з іншими біохімічними тестами. Так, визначення активності АсАТ та АлАТ більш достовірно відображає ступінь репаративних процесів у печінці при гепатиті, ніж уміст білірубіну.
Багато ферментів використовують у клініці для прогнозування результату хвороби. Наприклад, постійне зниження активності ХЕ при хронічному гепатиті свідчить про прогресування процесу й несприятливий прогноз. Різке зниження активності амінотрансфераз на фоні збільшення вмісту білірубіну свідчить про виснаження тканинних джерел ферментів за рахунок тяжкого ушкодження паренхіми печінки.
2.2
Ізоферменти — це субстратспецифічні ферменти, що каталізують одну й ту саму біохімічну реакцію, відрізняються величиною молекулярної маси, амінокислотним складом, електрофоретичною рухливістю, термостабільністю, оптимумом рН, дією на них активаторів та інгібіторів, а також імунологічними характеристиками. Як правило, це олігомерні білки, що утворені різними протомерами, які кодуються різними генами. Часто певна тканина синтезує переважно один із протомерів. Активний олігомерний фермент може бути побудований із таких протомерів у різних комбінаціях, у результаті чого утворюються ізоферментні форми. Таким чином, різні форми ферментів можуть відрізнятися за органом, у якому вони переважно синтезуються (печінка, серце, мозок та ін.), за локалізацією в клітині (мітохондрії, цитоплазма і т. п.), а також за генною структурою індивідуума.
На рисунку 1 наведено комбінації протомерів для ізоферментів КК і ЛДГ.
(а) (б)
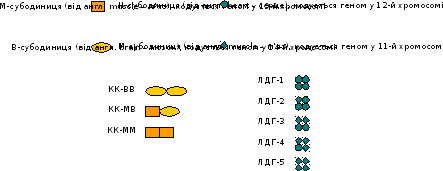
Рисунок 1 – Ізоферменти КК (а) та ЛДГ (б)
При ушкодженні тканин ізоферменти надходять у кров та інші біологічні рідини, в результаті чого їх ізоферментний набір стає близьким до тканинного. Цей процес лежить в основі використання ізоферментів у діагностиці та дає можливість із великою достовірністю встановити локалізацію патологічного процесу, що є особливо цінним при нерізко вираженій патології. Дослідження ізоферментів має переваги перед визначенням загальної активності ферментів, оскільки має одночасно більші чутливість і специфічність. Ізоферментні спектри широко використовуються при різних видах патології, перш за все в гепатології, кардіології, при захворюваннях нирок, підшлункової залози, легень, скелетних м’язів, в онкології, гематології та ін.
До ферментів, що існують у вигляді ізоферментів, належать амінотрансферази, лактат-, малат-, глутамат-, алкоголь-, ізоцитратдегідрогенази, альдолаза, амілаза, ліпаза, холінестераза, лужна фосфатаза, креатинкіназа та ін.
Залежно від віку, статі, фізичного стану людини в організмі встановлюється те або інше співвідношення ізоферментів, якому відповідає певний рівень активності в цілому. Зміна співвідношення ізоферментів в організмі або в окремих його органах і тканинах є одним із шляхів регуляції метаболічних процесів.
2.3
Слід регулярно перевіряти правильність і відтворюваність результатів аналізу з контрольних сироваток, які атестовані відповідними методами.
При оцінці отриманих результатів необхідно враховувати фізіологічні коливання активності ферментів. Так, існують деякі вікові відмінності у ферментних показниках. У новонароджених та у ранньому дитячому віці активність більшості ферментів дещо вища, ніж у дорослих. У людей похилого віку активність АсАТ, АлАТ, МДГ та деяких інших ферментів характеризується більш високими показниками. Емоційне навантаження, м’язова робота викликають невеликі зсуви активності ферментів. Так, у нетренованих людей тривале фізичне навантаження приводить до помітного коливання активності АсАТ, ЛДГ, МДГ, альдолази і особливо КК. Вагітність також виявляє певний вплив на активність ряду ферментів: у останні тижні відзначається невелике підвищення АсАТ, КК і ЛДГ. Арилсульфатаза, ЛАП, β-глюкуронідаза і гістаміназа при вагітності також змінюють свою активність, яка нормалізується через декілька днів після пологів.
Крім того, ферментні показники можуть зазнавати індивідуальних коливань, що пов’язані з генетичними особливостями, характером харчування, професією, способом життя людини та ін.
Під кількістю ферменту розуміють концентрацію специфічного білка, а під активністю – його здатність прискорювати перебіг біохімічної реакції. Для більшості ферментів з визначеної активності можна судити і про їх кількість. Але є й такі ферменти, специфічні зміни яких відображає лише масова концентрація, наприклад, креатинкіназа та її ізофермент MB.
Комісія з ферментів Міжнародного біохімічного союзу встановила, що одиницю каталітичної активності ферменту можна визначити як кількість ферменту, що каталізує перетворення 1 мкмоль субстрату за 1 хв за оптимальних умов. Ця одиниця називається міжнародною одиницею, MО, або IU (International Unit). У системі СІ одиницею каталітичної активності ферменту є катал (кат), який відповідає кількості ферменту, що перетворює 1 моль субстрату за 1 с при оптимальних умовах. При цьому об’ємна активність ферменту виражається як МО/л або кат/л, або кат/м3 і має назву концентрації каталітичної активності, або каталітичної концентрації, на відміну від питомої активності, яка виражається в МО/мг білка. У разі визначення масової концентрації ферменту, наприклад, креатинкінази MB, її виражають у мкг/л, використовуючи імунохімічні методи (радіоімунологічний аналіз або імуноензимометричні тести).
Активність ферментів in vivo та in vitro залежить не тільки від їх концентрації, але також від наявності активаторів та інгібіторів. Деякі чинники, пов’язані з проведенням аналізів, можуть впливати in vitro на активність ферменту. Тому в різних лабораторіях можуть бути одержані різні результати під час вимірювань активності одного й того ж ферменту в однакових, здавалося б, одиницях. Подібним же чином у різних лабораторіях можуть надавати різного діагностичного значення кількісним співвідношенням активності одного ферменту до такої іншого. Важливими чинниками вважають природу використаних субстратів, буферних розчинів і температуру проб. Оскільки у визначенні «міжнародних одиниць» ці чинники не враховуються, результати, одержані в різних лабораторіях і виражені в однакових, здавалося б, одиницях, можуть бути безпосередньо незіставними. Тому при інтерпретації результатів визначення активності ферментів їх необхідно порівнювати з одержаними в цій самій лабораторії даними про діапазон нормальних варіацій.
2.4 . Зміни активності ферментів при захворюваннях серця та скелетних м’язів
Ферменти сироватки крові: КК, АсАТ, АлАТ, МДГ, ІДГ, α-ГБДГ, глюкозофосфатізомераза, гексокіназа, альдолаза, транскетолаза та їх ізоферментні спектри.
Ферменти сечі: АлАТ, АсАТ, аланінамінопептидаза, ЛДГ, ЛФ та ін.
Вважається, що гіперферментемія, на відміну від таких неспецифічних показників, як лейкоцитоз, ШОЕ, диспротеїнемія та ін., відображає безпосередньо процес некрозу міокарда та є наслідком виходу ферментів із ураженої ділянки міокарда в кров’яне русло. Динаміка активності ферментів, що мають першорядне практичне значення в діагностиці інфаркту міокарда, подана в табл 5.
Таблиця 5 – Зміна активності деяких ферментів при інфаркті міокарда
(за Ф. І. Комаровим та ін.)
|
Фермент |
Початок підвищен-ня актив-ності, год |
Максимум підвищен-ня актив-ності, год |
Нормалі-зація ак-тивності, доби |
Очікуване збільшен-ня (рази) |
|
КК |
2–4 |
12–24 |
1–4 |
у 50 |
|
ЛДГ загальна |
12–24 |
36–72 |
10–12 |
у 20 |
|
Ізофермен-ти ЛДГ1 і ЛДГ2 |
6–12 |
24–36 |
14–21 |
20 |
|
АсАТ |
6–12 |
24–36 |
3–5 |
у 15–30 |
Як видно з табл. 5, найшвидше при інфаркті міокарда підвищується активність КК. Вже до кінця 1-ї доби вона досягає максимуму, перевищуючи нормальні величини в 5–20 разів і навіть більше. Підвищення активності КК виявляють у 95–99 % хворих на інфаркт міокарда. Особлива цінність цього показника пов’язана зі швидкістю зміни після початку захворювання. Слід підкреслити, що рівень КК порівняно швидко повертається до норми. Тому у випадках, коли його визначення не було виконане впродовж 2–4 діб після розвитку інфаркту, важко розраховувати на допомогу цього показника в діагностиці. У той самий час саме швидкість динаміки КК робить визначення цього ферменту особливо цінним для розпізнавання повторних інфарктів, які, не даючи чітких електрокардіографічних змін, можуть викликати повторний підйом КК (для виявлення їх рекомендується проведення повторних регулярних досліджень). Одночасне підвищення фракції MB ферменту КК (КК-МВ), якщо вона перевищить 6 % загальної активності КК, допомагає в ранній діагностиці інфаркту міокарда.
У найбільшій кількості із зони інфаркту в кров вивільняється ізофермент КК-ММ, він же – основний ізофермент у скелетному м’язі, період його напіввиведення з плазми довший, ніж у КК-МВ. Тому на 2–4-ту добу при високому рівні в сироватці загальної КК і нормальному рівні КК-МВ не виключений інфаркт міокарда як причина високої активності КК.
Необхідно також ураховувати, що підвищення активності КК можливе при прийманні алкоголю й після призначення препаратів, що активують фермент (наприклад, преднізолону).
Активність ЛДГ підвищується повільніше і залишається підвищеною довший час порівняно з іншими ферментами, отже, цей показник можна використовувати для оцінки ступеня виздоровлення. Повторні інфаркти викликають тривале підвищення активності цього ферменту. Активність ЛДГ може зростати в результаті патології печінки, зокрема, при розвитку після інфаркту застійних явищ у печінці. У таких випадках слід мати на увазі, що при інфаркті міокарда підвищується активність фракції ЛДГ1 і у меншій мірі ЛДГ2, тоді як при патології печінки – активність ЛДГ5.
Діагностична чутливість визначення ЛДГ1 при інфаркті міокарда становить близько 90%, діагностична специфічність – 90–99%. Більш ніж у 80 % усіх випадків інфаркту міокарда виникає так звана «інверсія» співвідношення ЛДГ1/ЛДГ2, яке стає більше 1, у нормі це співвідношення менше 1 і становить 0,6–0,7, у середньому 0,64. Поширеними причинами, що призводять до хибно позитивних результатів із підвищенням ЛДГ1 і ЛДГ1/ЛДГ2, є гемоліз та інфаркт нирки, при яких значення ЛДГ1 і ЛДГ1/ЛДГ2 змінюються так само, як при інфаркті міокарда.
Підвищення активності ЛДГ1 не спостерігається при стенокардії, тахіаритмії, перикардитах, зондуванні серця та ін.
У більшості випадків для встановлення діагнозу інфаркту міокарда разом із клінічною картиною та змінами ЕКГ достатньо вимірювання в плазмі активності загальної КК і ЛДГ1 (α-гідроксибутиратдегідрогенази). Підвищення в сироватці крові лише активності КК характерно не тільки для інфаркту міокарда. Так буває після внутрішньом’язових ін’єкцій, важкого фізичного навантаження, оперативного втручання, однак це, як правило, супроводжується нормальним рівнем активності в плазмі крові ЛДГ1 та АсАТ.
Активність АсАТ і АлАТ збільшується і при інфаркті міокарда, і при патології печінки, але при інфаркті міокарда активність АсАТ підвищується значніше, ніж при патології печінки. Тут можна використовувати коефіцієнт де Рітіса – відношення активності АсАТ/АлАТ. При інфаркті міокарда цей коефіцієнт більше 1,33, при ураженнях печінки – менше 1,33.
Для АсАТ простежується тісний кореляційний зв’язок із розмірами інфаркта. Неускладнений інфаркт міокарда, як правило, не призводить до збільшення АлАТ, у той самий час навіть невеликий за розмірами інфаркт через порушення функції правого шлуночка може викликати деяку недостатність печінки, що супроводжується підвищенням активності трансаміназ. Якщо ж є первинна патологія печінки, застійна серцева недостатність без інфаркта або емболія легеневої артерії, то підвищення в сироватці крові активності АсАТ не буде супроводжуватися підвищенням активності ЛДГ1.
Активність альдолази крові при інфаркті міокарда також підвищується, але в діагностиці інфаркту цей фермент, як і ряд інших, використовується менше.
Висока частота гіперферментемії при інфаркті міокарда свідчить про її велике значення для підтвердження діагнозу. У той самий час, ураховуючи, що підвищення активності ферментів у 1–5 % випадків безперечного інфаркту міокарда може не бути, відсутність гіперферментемії за наявності клінічних даних не дозволяє беззастережно виключити діагноз інфаркту міокарда. Виявлена залежність ступеня підвищення активності ферментів від величини ділянки некрозу дозволяє припустити у випадках відсутності гіперферментемії у хворих із відповідними клінічними і (або) електрокардіографічними даними інфаркт малого розміру.
Цінність ензимодіагностики як одного з методів розпізнавання інфаркту міокарда підвищується у зв’язку із установленою відсутністю підвищення активності ферментів сироватки крові при ряді захворювань, із якими доводиться проводити диференціальну діагностику інфаркту міокарда. Так, гіперферментемія ніколи не виникає при плевритах, міжреберній невралгії, при перикардитах (не пов’язаних із інфарктом міокарда).
Гіперферментемія, як правило, не виникає при нетривалих нападах стенокардії, а також при нападах, що піддаються дії нітрогліцерину. Є відомості про можливість підвищення активності КК-МВ при патології серця некоронарогенного походження – при міокардиті й міокардіодистрофіях різного походження; у цих хворих ферментемія помірна й триваліша, що звичайно відповідає фазі максимальної активності процесу.
При прогресивній м’язовій дистрофії і дерматоміозитах можливе підвищення активності в сироватці крові КК, ЛДГ, АсАТ (особливо КК) та інших ферментів.
Під час ранніх м’язових дистрофій активність КК є суттєво підвищеною (у 10 разів і більше). Дистрофія Дюшена є вродженим генетичним захворюванням, яке успадковується рецесивно через Х-хромосому. Хворіють хлопці, у яких відразу після народження виявляється дуже висока активність КК. У міру розвитку захворювання, коли зупиняється активний процес і м’язові клітини замінюються сполучною та жировою тканинами, активність ферменту поступово знижується і досягає норми. У жінок, які є носіями патологічного гена, має місце лише незначне підвищення активності. При інших формах дистрофії підвищення активності КК є виразно меншим, ніж під час хвороби Дюшена.
Активність КК є також підвищеною при різних міопатіях, наприклад, при міопатії у алкоголіків і при поліміозитах різної етіології. Під час м’язових захворювань нейрогенного походження (поліомієліт, запалення периферичних нервів і т. п.) активність КК, як правило, залишається в межах норми.
У диференціальній діагностиці ураження серцевого та скелетного м’язів використовується визначення коефіцієнта КК/АсАТ. Якщо КК/АсАТ менше 10, то це, вірогідніше, інфаркт міокарда, якщо КК/АсАТ більше 10, то це, швидше, ушкодження скелетних м’язів. Оскільки маса скелетних м’язів більша, ніж маса серця, то дуже сильне підвищення КК більш характерне для ураження скелетних м’язів (зокрема внаслідок гіпоксії), ніж для серцевого м’яза. У той самий час для ураження скелетних м’язів не характерне суттєве збільшення АсАТ у сироватці. При інфаркті міокарда коефіцієнт КК/АсАТ у середньому становить 5, з коливаннями в межах 2–9, при ураженні скелетних м’язів це співвідношення в середньому становить 27 (коливання 13–56).
При больовому синдромі буває досить складно локалізувати ділянку й орган ушкодження. Іррадіація болю при патології з боку легень, органів грудної клітки може хибно свідчити про інфаркт міокарда. У свою чергу, інфаркт міокарда може супроводжуватися абдомінальними болями. У таблиці А.4 наведені відносні зміни активності ферментів у сироватці крові при гострих загрудинних чи абдомінальних болях.
Підсумовуючи вищесказане, можна зробити висновок, що, по-перше, гіперферментемія не є патогномонічним симптомом некрозу міокарда, по-друге, відсутність її не дає підстав для беззастережного виключення діагнозу інфаркту. У той самий час слід підкреслити, що ензимодіагностика виконує першорядну роль у розпізнаванні інфаркту міокарда. В ензимодіагностиці інфаркту міокарда велика роль надається:
1) визначенню активності не одного, а декількох із перелічених ферментів;
2) повторному багаторазовому дослідженню;
3) оцінці змін активності «серцевих» ферментів на різні терміни (виходячи з клінічних даних) від вірогідного часу початку захворювання.
Результати дослідження ферментативної активності слід оцінювати обов’язково в комплексі з клінічними, електрокардіографічними даними й результатами інших лабораторних досліджень.
