
- •Міністерство освіти та науки україни
- •1. Найпростіші стехіометричні розрахунки
- •Домашнє завдання
- •2.Еквіваленти простих та складних речовин
- •1/3,1/3 Aici3, 44,5 г/моль; 1/2, 1/2н2о, 9 г/моль.
- •3. Будова атома
- •Корисно зрозуміти і запам'ятати взаємозв'язок основних фізичних характеристик – мас m і зарядівq– складаючих атом частинок з іншими хімічними константами:
- •Не можна одночасно точно визначити положення в просторі й імпульс (швидкість) мікрочастинки. Цей факт визначається співвідношенням невизначеностей Гейзенберга:
- •Де х і р – невизначеності у величинах відповідно координати й імпульсу.
- •Електронна ємність енергетичних рівнів і підрівнів
- •Заповнення підрівнів по періодах періодичної системи
- •Електронні сімейства елементів
- •4. Періодичний закон
Електронні сімейства елементів
|
Електронне сімейство |
Положення в періодичній таблиці |
Коротка електронна формула |
|
s- сімейство
р- сімейство
d- сімейство f – сімейство |
головні підгрупи I - II груп і елемент He головні підгрупи III - VIII груп (виключаючи He) побічні підгрупи I-VIII груп лантаноїди та актиноїди
|
ns1-2
ns2np1-6 ns2(n – 1)d1-10 ns2(n – 1)d1(n-2)f1-14
|
Щоб скласти скорочену електронну формулу елемента, виходячи з узагальненої формули сімейства, необхідно:
- визначити, до якого сімейства відноситься елемент і взяти відповідну узагальнену формулу;
- підставити в цю формулу значення n, що дорівнює номеру періоду, у якому розташований елемент;
- визначити кількість електронів на заповнюваному підрівні, відрахувавши від першого елемента сімейства у даному періоді і підставити цю кількість у формулу.
Для наочності розподіл електронів на підрівнях показують за допомогою графічних схем валентних орбіталей. Вони використовуються наряду з короткими електронними формулами.
Приклад 4. Напишіть короткі електронні формули і побудуйте графічні схеми валентних орбіталей зазначених атомів: Са, Ni, Se, Sm.
Розв’язання. Са– другий від початку IV періоду елемент s-сімейства:
![]()
Ni – восьмий, відраховуючи від Sc, d-элемент IV періоду:

Se– четвертий,відраховуючи відGa,p-элемент IVперіоду:
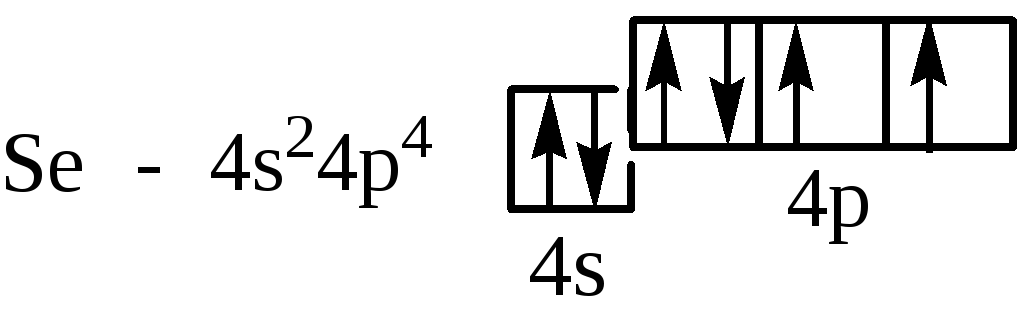
Sm – пятий від Ce у ряду лантаноїдів – f-элементів VI періоду:

На електронну структуру деяких атомів впливає симетрія електронного розподілу. Наприклад, електронну формулу атома хрому – четвертого, відраховуючи від скандію Sc, у сімействі d-елементів IV періоду – за викладеними правилами варто записати так: 4s23d4. Однак, реалізується конфігурація з заповненими по одному електрону п'ятьма d- орбіталями, що має більш симетричний розподіл електронного заряду (і тому – меншу енергію): 4s13d5. З цієї ж причини електронна конфігурація міді в основному стані не 4s23d9, а 4s13d10. Така ситуація одержала назву "провал електрона" (з n на (n-1) рівень). Найбільшій симетрії відповідають цілком або наполовину заповнені підрівні (p3 і p6, d5 і d10, f7 і f14). У атома паладія Pd з 5s-підрівня "провалюються" обидва електрони: 4s24p65s24d8 4s24p64d10. Тому паладій – єдиний елемент періодичної системи, у якого головне квантове число електронів зовнішньої оболонки не збігається з номером періоду.
Будьте уважні при роботі з елементами d- і f- сімейств. Якщо вам потрібна точна електронна формула, звіряйтеся зі спеціальними таблицями електронних конфігурацій.
Варто пам'ятати, що всі розглянуті електронні формули відносяться до атомів, що знаходяться в стаціонарному (незбудженому) стані. Однак за певних умов може відбуватися розпаровування електронних пар при переході атомів у збуджений стан, внаслідок чого кількість неспарених електронів зростає. При цьому електрони переходять (промотуються) на вільну орбіталь розташованого вище по енергії підрівня в межах того ж енергетичного рівня.
Приклад 5.Складіть короткі електронні формули і графічні схеми атома хлору в основному (стаціонарному) і збудженому станах.
Розв’язання.Складаємо електронну формулу і схему електронної структури атома хлору в основному стані:
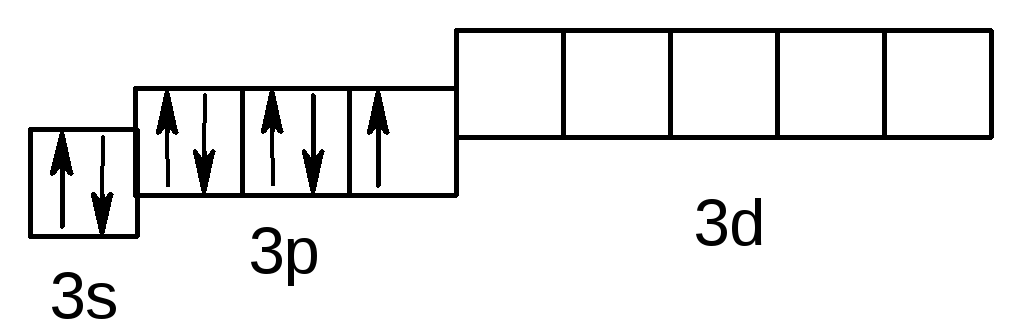
Cl– 3s23p5
У збудженому стані (позначається символом * ) спарені 3s і 3p електрони можуть роз'єднуватися, переходячи на вільні орбіталі підрівня 3d:

Cl* – 3s23p43d1
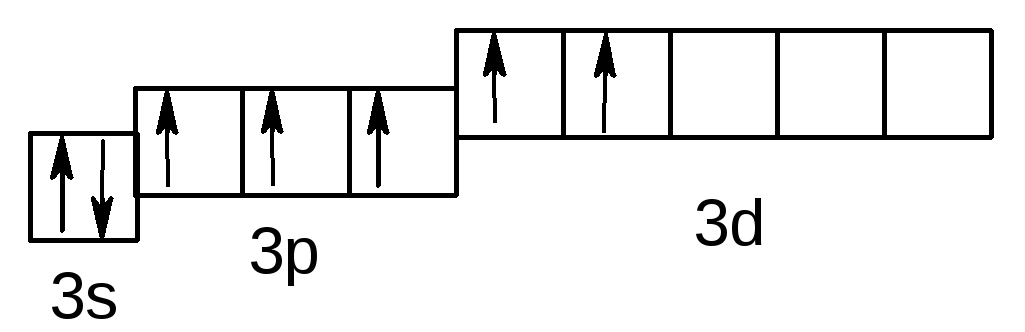
Cl** – 3s23p33d2
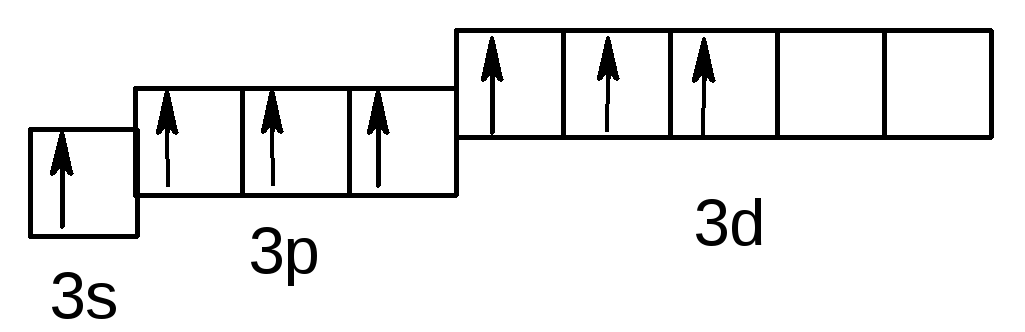
Cl***– 3s13p33d3
Зверніть увагу, що атом хлору може існувати у трьох збуджених станах. Чи можлива наявність збудженого стану у атома фтору?Поясність вашу відповідь.
Навчившись писати короткі електронні формули атомів елементів, неважко складати електронні формули іонів, що відповідають існуванню елементів у різних ступенях окиснення. Для цього спочатку складають короткі електронні формули нейтральних атомів, а потім добавляють до неї (при утворенні аніонів) або видаляють (при утворенні катіонів) відповідну кількість електронів.
Приклад 6. Складіть електронні формули іонів і елементів у різних ступенях окиснення: S2- , S+2 , S+4 , S+6.
Розв’язання.Спочатку складаємо коротку електронну формулу і графічну схему атома S:
![]()
S0 3s23p4
Для одержання іона S2- до S0 необхідно додати два електрона:
![]()
S2- 3s23p6
Щоб перейти від S0 до станів S+2, S+4, S+6 необхідно видалити з нейтрального атома сірки два, чотири або шість електронів відповідно.
![]()
S+2 3s23p2
![]()
S+4 3s2 3p0
![]()
S+6 2s22p63s03p0
ДОМАШНЄ ЗАВДАННЯ
1. Який елемент має в атомі п'ять електронів, для кожного з яких n =3 і l =2? Чому дорівнюють для них значення ml? Чи повинні вони мати антипаралельні спіни?
2. Який елемент має чотири електрони, для кожного з яких
n = 4 і l = 1? Чому дорівнюють для них значення ml? Скільки електронів мають антипаралельні спіни?
3. Укажіть значення квантових чисел n, l і ml для валентних електронів в атомах елементів з порядковими номерами 19, 23, 27, 30, 33 і 36. Для визначення значень ml виходьте з припущення, що орбіталі кожного підрівня заповнюються в порядку збільшення ml, починаючи з його найбільш негативного значення.
4. Скільки електронних шарів і яке число електронів містить атом з валентною оболонкою: а) 4s24p5; б) 4s23d5; в) 5s25p3 ?
5. В атомі деякого елемента є п'ять електронних шарів і 6 валентних електронів. Якими квантовими числами вони характеризуються?
6. Які з приведених електронних конфігурацій неможливі і чому: 3s23p5, 3s22d6, 4s24p7, 2s32p3, 5s24d8, 4s23d12, 3s23p2, 5s23f15, 6s24f5, 2s12p3, 4s13d10, 4s23d54p1?
7. Яку з вільних атомних орбіталей (АО) заповнить черговий електрон відповідно до правил Клечковського: а) 4d- чи 5s-; б) 5p- чи 4d-; в) 5f- чи 4d-; г) 5p- чи 6s-; д) 5f- чи 6s- ?
8. Для скількох АО сума (n + l) = 8? Чи заповнені такі орбіталі в незбуджених атомах елементів періодичної системи? Атоми яких елементів мають найбільше значення суми (n + l)?
9. Скільки електронних шарів мають атоми елементів з порядковими номерами 8, 10, 18, 35, 39, 56, 80, 86? Скільки з них заповнені цілком і скільки частково? Спробуйте вирішити цю задачу без допомоги таблиці Менделєєва.
10. Визначте сумарний спін валентних електронів в атомах елементів з порядковими номерами 19, 20, 22, 25, 27, 30, 33, 36. Спробуйте вирішити цю задачу без допомоги таблиці Менделєєва.
У задачах 11-20 напишіть скорочені електронні формули і побудуйте графічні схеми валентних орбіталей зазначених елементів у різних ступенях окиснення.
11. Ca, Cr, Se, Se-2, Se+6
12. Ge, Zr, Rb, Rb+, Br-
13. Sr, Nb, Sb, Al+3, F-
14. Cs, Ta, B, B+3 , Br+5
15. C, Ti, He, Ti+3, Ti+4
16. W, Sb, Ra, Cl-, Cl+5
17. Na, Zn, As, Mn+2, Mn+4
18. Au, Mg, Pb, Pb+2, Pb+4
19. K, Cu, P, Cu+, Cu+2
20. Br, V, Be, Be+2, H-
