
шпори2 / 55-58Без56_1
.doc|
55 |
56 |
57 Початок |
|
55. Типи діаграм стану бінарних систем: евтектичного типу, утворення неперервних рядів твердих розчинів та методи побудови. Фазовий склад і структуру сплаву в залежності від температури і концентрації в зручній графічній формі показують діаграми стану. Діаграми стану подвійних систем будують у координатах температура-хімічний склад сплаву. Вид діаграми визначається особливостями компонентів, які формують даний сплав і характером їх взаємодії. Діаграми надають інформацію про температури початку і закінчення перетворень сплавів, що, в свою чергу, дозволяє підібрати режим термічної обробки і визначити кінцеву структуру сплаву після охолодження. Побудова діаграм стану основана на фіксації характерних точок сплаву, що мають місце при його охолодженні. Для чого в сплав (1), що охолоджується поміщається термопара (2) і спеціальним приладом (3) проводиться запис температури в процесі охолодження сплаву. Аналогічний процес проводиться для декількох складів сплаву. При зміні фазового складу сплаву на кривій зниження температури, в залежності від числа ступенів свободи, буде спостерігатися перегин (рис. 4.1.б), або горизонтальна лінія. Відповідні температури, при яких проходять такі зміни наносяться на вертикальну лінію, яка на діаграмі стану показує склад нашого сплаву. Провівши подібні виміри для декількох сплавів різного складу (рис. 4.1.в) та з’єднавши відповідні точки, отримаємо діаграму стану для подвійних сплавів компонентів А і В.
Ліквідус- крива на діаграмі стану, вище якої всі сплави знаходяться в рідкому стані. Крива ліквідус показує, як змінюється температура початку кристалізації сплавів в залежності від їх хімічного складу. Нижню криву називають кривою солідус, або кривою кінця кристалізації. Нижче неї всі сплави знаходяться у твердому стані і мають однофазну структуру твердого розчину Розглянемо діаграму стану сплаву механічна суміш (рис.2). Лінія асв –лінія ліквідус, а лінія акслв – лінія солідус.
|
56. Залізовуглицеві сплави. Діаграма фазової рівноваги системи «залізо-вуглець» Сталі та чавуни. Розрізняють чисті залізовуглецеві сплави (із слідами домішок), що отримуються в невеликих кількостях для дослідницьких цілей, і технічні залізовуглецеві сплави, що містять домішки, що легують елементи і спеціальні добавки. Початок вивченню діаграми залізо — вуглець поклав Чернов Д. К. в 1868 році. Чернов вперше вказав на існування в сталі критичних точок і на залежність їх положення від вмісту вуглецю. Діаграма залізовуглецевих сплавів може бути представлена в двох варіантах: метастабільному, що відображає перетворення в системі «залізо-карбід заліза», та стабільному, такому, що відображає перетворення в системі «залізо-графіт». Найбільше практичне значення має діаграма стану «залізо — карбід заліза», оскільки для більшості технічних сплавів перетворення реалізуються по цій діаграмі. Карбід заліза (Fe3C) називають цементитом, тому метастабільну діаграму залізовуглецевих сплавів називають діаграмою достатку «залізо-цементит» (Fe — Fe3C).
Розглянемо характерні лінії і точки на діаграмі стану. Характерні лінії: АСD — ліквідус(крива на діаграмі стану, вище якої всі сплави знаходяться в рідкому стані. Крива ліквідус показує, як змінюється температура початку кристалізації сплавів в залежності від їх хімічного складу); АЕСF — солідус(кривоf кінця кристалізації. Нижче неї всі сплави знаходяться у твердому стані і мають однофазну структуру твердого розчину). Вище лінії АСD сплави системи перебувають у рідкому стані. По лінії АС з рідкого розчину починають випадати кристали твердого розчину вуглецю в γ — залізі, який називається аустенітом, отже, в області АСЕ буде суміш двох фаз — рідкого розчину і аустеніту; по лінії СД з рідкого розчину починають випадати кристали цементиту; в області СЕF міститься суміш двох фаз — рідкого розчину і цементиту. Перетворення у твердому стані (вторинна кристалізація) проходить по лініях GSE, PSK і GPQ . Перетворення у твердому стані відбуваються внаслідок переходу заліза з однієї модифікації в іншу, а також у |
57. Основні методи очистки матеріалів для електронної техніки. Розподіл домішок при спрямованій кристалізації та зонному плавленні. В основах всіх методів глибокої очистки матеріалів використовується відмінність в хімічних, фізичних та фізико-хімічних властивостях, що підлягають розділенню. Звідси слідує, що чим більша відмінність властивостей компонентів, тим легше їх розділити і навпаки. Тому і класифікація методів базується на поділі по властивостям речовин, що використовуються для розділення компонентів і має слідуючий вигляд: 1. Процеси, що базуються на сорбції. 2. Процеси, що базуються на екстракції. 3. Кристалізаційні процеси. 4 . Перегонка через газову фазу. 5. Електроліз. 6. Процеси, що базуються на відмінності коефіцієнтів дифузії. 7. Вибіркове осадження, окислення і відновлення. 8. Вибір найбільш ефективного методу (або комбінації методів) для очистки кожного індивідуального матеріалу проводять, виходячи з конкретних фізико-хімічних властивостей цього матеріалу і його сполук. 1)Сорбційні процеси: під сорбцією в загальному випадку розуміють процеси поверхневого (адсорбція) і об'ємного (абсорбція) поглинання речовини на межі розділу двох фаз: твердої і рідкої, твердої і газоподібної, рідкої і газоподібної. Адсорбційна система складається з адсорбента-речовини, на поверхню якої йде поглинання і адсорбата-речовини, молекули якої поглинаються. Зворотній процес-видалення молекул з поверхні адсорбента - називається десорбцією. За природою процесів адсорбцію ділять на фізичну і хімічну.
При фізичній адсорбції молекули адсорбата не вступають в хімічну взаємодію з адсорбентом і, таким чином, зберігають свою індивідуальність на поверхні поглинача; 2) Процеси рідинної екстракції: екстракція в загальному випадку - це процес вибіркового видобування речовини в рідку фазу. Екстракцію газу рідиною називають адсорбцією, твердих речовин рідкими - вилуджуванням, екстракцію розчиненої речовини із одної рідкої фази в іншу – рідинною екстракцією або просто екстракцією 3) Кристалізаційні методи: базуються на різній розчинності домішок в рідкій і твердій фазах. Досить широка по конструктивному оформленню група методів напрямленої кристалізації може |
|
55 Продовження |
56 Продовження |
57 Продовження |
|
Діаграми стану подібного типу при певній концентрації компонентів мають найнижчу температуру плавлення (т.с), яка називається евтектичною температурою. При цій температурі проходить евтектичне перетворення, суть якого в одночасному виділенні з рідини двох або більше типів кристалів, які мають свої типи кристалічної гратки. Кристалики дуже малих розмірів, в оптичних мікроскопах часто не розрізняються і спостерігаються як єдине зерно евтектики. При цьому рентгеноструктурний аналіз показує наявність двох або більше типів кристалічних граток. Для зображення евтектичної механічної суміші компоненти беруть в дужки (А+В). Тоді евтектичне перетворення буде мати вигляд L=(А+В). В сплавах механічна суміш нижче лінії ліквідус з рідини виділяються кристали чистих компонентів А або В. При цьому лівіше т.с буде рідина і кристали компоненту А, а правіше – рідина і компонент В Якщо атоми однієї речовини заміщуються атомами іншої речовини в широких межах, враховуючи повне заміщення власних атомів, то утворюється неперервний ряд твердих розчинів. Неперервні тверді розчини утворюються, як правило, між ізоструктурними речовинами. |
зв'язку зі зміною розчинності вуглецю в залізі. В області діаграми AGSE міститься аустеніт. При охолодженні сплавів аустеніт розпадеться з виділенням по лінії GS фериту (твердий розчин вуглецю в α — залізі), а по лінії SE — цементиту (хімічна сполука Fe3C). Цементит, що випадає з твердого розчину, називається вторинним, на відміну від первинного, який випадає з рідкого розчину. В області діаграми GSP міститься суміш двох фаз — фериту і аустеніту. Характерні точки. У точці С при вмісті 4,3% вуглецю і температурі 1420 0К відбувається одночасно кристалізація аустеніту і цементиту і утворюється їх тонка механічна суміш евтектика, яка називається ледебуритом. Точку С називають ев-тектичною точкою. Ледебурит є у всіх сплавах, які містять від 2,14 до 6,67% вуглецю. Такі сплави є чавунами. Точка Е відповідає граничному насиченню заліза вуглецем (2,14%). Сплави, які лежать ліворуч від цієї точки, належать до сталей.
Сталь — сплав заліза з вуглецем, який містить до 2,14 % вуглецю. За вмістом вуглецю сталі поділяють на дві групи: м'яка сталь, або технічне залізо (містить до 0,3 % вуглецю) тверда сталь (містить від 0,3 до 2,14 % вуглецю) Суть процесу переробки чавуну на сталь полягає у зменшенні до потрібної концентрації вмісту вуглецю і шкідливих домішок — фосфору і сірки, які роблять сталь крихкою і ламкою. Залежно від способу окиснення вуглецю існують різні способи переробки чавуну на сталь: конверторний, мартенівський і електротермічний. В Україні найбільш поширений мартенівський спосіб, за яким одержують понад 80 % світової виробки сталі. Конверторний спосіб За цим способом окиснення надлишку вуглецю та інших домішок чавуну проводять киснем повітря, який продувають крізь розплавлений чавун під тиском у спеціальних печах — конверторах. |
бути зведена до трьох основних: а) витягування кристалів з розплаву (метод Чохральського) б) нормальної напрямленої кристалізації (метод Бріджмена) в) зонної перекристалізації або зонної плавки (вперше запропонований Пфанном). 4) Процеси перегонки через газову фазу: процеси перегонки через газову фазу лежать в основі очистки простих речовин і хімічних сполук, що мають високу пружність парів. Сублімація (возгонка) являє собою процес безпосереднього переходу речовини із твердого стану в пароподібний. Сублімація як метод розділення і очистки можлива для тих речовин, які при температурі нижче точки плавлення характеризуються досить високим тиском парів. Дистиляція являє собою процес розділення рідкого розчину у його складові частини, що характеризуються різним тиском парів шляхом їх випаровування з наступною конденсацією утворену парів. 5)Електроліз: Електрохімічні методи очистки здійснюються шляхом проведення окисно-відновних процесів на електродах в електроліті при проходженні через останній струму. Вихідний матеріал завантажують у вигляді анода, який в процесі електролізу розчиняється і очищений матеріал збирається на катоді. На поверхні анода протікає реакція окислення А→Аn++пе з переходом іона речовини Аn+ в розчин і електрона e по зовнішній ділянці кола на катод; на катоді йде реакція відновлення Аn++пе →А, в результаті якої проходить виділення речовини А на катоді. |
|
58 Початок |
|
58 Продовження |
|
58. Методи вирощування монокристалів. Одержання монокристалів з парової фази, розплаву та з розчинів. Метод Чохральського для одержання монокристалів кремнію. Монокристали знайшли широке застосування в сучасній науці і техніці завдяки своїм вираженим властивостям в порівнянні з полікристалічними або аморфними тілами. У природі монокристали зустрічаються рідко, тому їх виготовляють штучно: з розчинів, розплавів, газотранспортними реакціями. З розчинів. Маленький кристал (затравку) підвішують на нитці в кристалізаторі з насиченим розчином цієї речовини. Створюють умови, щоб цей розчин став пересиченим (поступовим зниженням температури). Щоб кристал ріс рівномірно, він обертається. Так вирощують монокристали водорозчинних речовин. Швидкість росту мала (соті частки міліметра за годину), тому кристал вирощують кілька місяців, але вони можуть мати масу в десятки кілограмів. З розплаву. Вирощують з розплаву самої речовини або з розчину у розплаві з іншими сполуками. По Чохральскому затравку опускають у розчин, а потім поступово витягують його. За методом Бріджмена полікристалічний порошок, розчинений у ампулі, переміщується у вертикальній печі з різною температурою. Коли нижній кінець ампули потрапляє з ділянки з високою у ділянку з більш низькою температурою, починається ріст монокристала, який заповнює з часом всю ампулу. Кристал, що утворився, має форму ампули i називається "буля". Метод зонної плавки відрізняється тим, що човник переміщується горизонтально вперед i назад кілька разів, внаслідок чого домішки концентруються на кінцях кристала i він очищується. Процеси росту можна класифікувати по слідуючій схемі: А. Тверда фаза - тверда фаза 1 Рекристалізація - твердофазний процес, що протікає без зміни симетрії кристалічної ґратки. Поширений метод рекристалізації в процесі деформаційного відпалу (зняття напруг). 2. Перекристалізація - твердофазний процес, що проходить утворенням нових структур з граткою іншої симетрії. Використовують методи перекристалізації при поліморфних перетвореннях, з аморфного стану і перенасиченого твердого розчину. Б. Рідина - тверда фаза 1 Консервативні процеси: а) пряме тверднення (метод Бріджмена-Стокбаргера); б) охолоджувана затравка (метод Кіропулоса); в) витягування (метод Чохральського); 2. Неконсервативні процеси: а) зонна плавка (горизонтальна, вертикальна, по методу плаваючої зони, на рухомій підкладці); б) метод Вернейля (плавлення в полум'ї, плазмі, електричній дузі) В. Газ - тверда фаза І Сублімація-конденсація. Хімічні транспортні реакції. Напилення. Ріст кристалів із парів. Методи вирощування по механізм пара-кристал можна систематизувати слідуючим чином: 1. Методи вирощування в однокомпонентних системах:а) сублімація-конденсація; б) розпилення; в) іонне розпилення. |
|
|
|
|
|
58 Продовження |
|
|
|
2. Методи вирощування в багатокомпонентних системах: а) зворотні реакції; б) незворотні реакції. Ріст монокристалів з розплаву. Ріст кристалів по механізму рідина-кристал являє собою найбільш поширений процес промислового вирощування монокристалів. Багато речові І не вдається виростити із власних чистих розплавів по: слідуючим причинам Матеріал розкладається ще до плавлення або плавиться інкогруентно. Речовина сильно розкладається ще до плавлений або у неї дуже велика пружність пари при температурі плавлення. Потрібна поліморфна модифікація структурно не стійка в контакті з розплавом, а в результаті твердофазних переходів не можна одержати якісних кристалів даної модифікації. Температура плавлення настільки висока, що вирощування монокристалів з розплаву практично не можливо. Умови вирощування не допускають введення якого-небудь активатора в кристал. Ріст кристалів із рідких розчинів Різні методи вирощування кристалів в багатокомпонентних системах мають багато спільного. В зв'язку з тим, що фази, які кристалізуються, завжди містять додаткові компоненти, їм властиві недоліки, зв'язані з ростом в багатокомпонентних системах. Але ці методи мають і певну перевагу, зв'язану з низькими температурам процесів. Якщо класифікувати ці методи по способу створення перенасичення, то можна одержати слідуючий перелік: Ізотермічні методи. Випаровування розчинника або зменшення розчинності шляхом додавання іншого розчинника. Перепад температури. Хімічна або електрохімічна реакція. Неізотермічніметоди. Повільне охолодження. Зонна плавка при наявності температурного градієнта,якщо він прикладений до всього зразка. Метод Чохральського і аналогічні йому методи. Метод витягування з розплаву, вперше введений в практику Чохральським, дозволяє усунути механічний вплив тигля на кристал. Для успішного використання цього методу необхідні слідуючі умови: 1. Кристал повинен плавитися, без розкладання. Якщо кристал плавиться іконгруентно, його деколи вдається виростити із розплава такого складу, де кристал являється стійкою фазою. Але це вже ріст із багатокомпонентної системи.Якщо продуктом розкладу являються гази, можна використати герметичну апаратуру . Рівноважний тиск продуктів розкладу що встановиться, подавить розкладання. 2.Кристал не повинен реагувати з тиглем і атмосферою. Герметична апаратура дозволяє підтримувати нейтральне, окисне або відновне середовище. 3.Температура плавлення кристала повинна бути нижче температури плавлення тигля. 4. Апаратура повинна забезпечувати регулювання швидкості витягування в відповідності з градієнтом в зоні утворення монокристала. Д
|




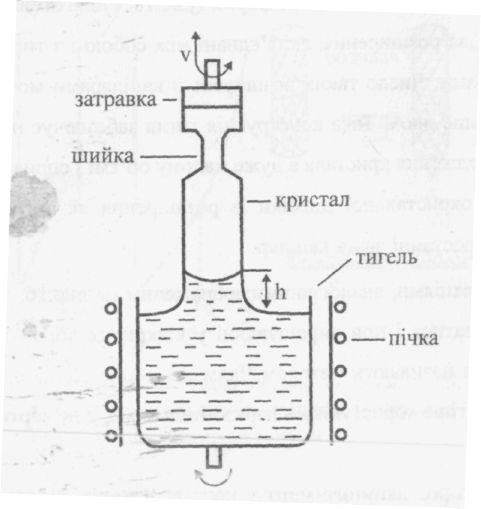 уже
важлива перевага методу витягування
- можливість нарощувати кристал на
затравку в строго контрольованих
умовах. Якщо немає затравки, легко
викликати спонтанне зародження на
дротині.
уже
важлива перевага методу витягування
- можливість нарощувати кристал на
затравку в строго контрольованих
умовах. Якщо немає затравки, легко
викликати спонтанне зародження на
дротині.