
- •Методичні розробки
- •Частина 1
- •Ужгород – 2002
- •Передмова
- •Техніка експерименту в хімічній лабораторії
- •Загальні правила роботи в хімічній лабораторії
- •Предмет
- •Атомно-молекулярна теорія
- •Основні
- •Поняття
- •Прості та складні речовини
- •Хімічна символіка
- •Фізичні величини
- •Закон збереження маси
- •Закон еквівалентів
- •Закон сталості складу речовини
- •Закон кратних відношень
- •Газові закони
- •Закон Авогадро
- •Рівняння Менделєєва-Клапейрона
- •Хімічна термодинаміка
- •Термодинамічна система
- •Внутрішня енергія системи
- •Перший закон термодинаміки
- •Ентальпія системи
- •Тепловий ефект реакції
- •Закони термохімії
- •Термохімічні рівняння реакцій
- •Стандартний стан речовини
- •Термохімічні розрахунки
- •Поняття про ентропію
- •Другий закон термодинаміки
- •Хімічна кінетика
- •Поняття про швидкість хімічної реакції
- •Швидкість гомогенних реакцій
- •Швидкість гетерогенних реакцій
- •Залежність швидкості хімічної реакції від температури
- •Енергія активації хімічної реакції
- •Фотохімічні реакції
- •Ланцюгові реакції
- •З розгалуженими ланцюгами
- •Оборотні та необоротні реакції
- •Хімічна рівновага
- •Зміщення хімічної рівноваги
- •Фазові рівноваги
- •Каталіз
- •Розчини
- •Дисперсні системи
- •Розчини
- •Теорії розчинів
- •Розчинність речовин
- •Розчини
- •Розчини
- •Розчини твердих речовин
- •Способи вираження концентрації розчинів
- •Розчини неелетролітів
- •Тиск пари розчинів
- •Температура кипіння і температура замерзання розчинів
- •Розчини електролітів
- •Теорія електролітичної дисоціації
- •Ступінь електролітичної дисоціації
- •Ізотонічний коефіцієнт
- •Константа електролітичної дисоціації
- •Закон розведення
- •Властивості розчинів сильних електролітів
- •Добуток розчинності
- •Іонний добуток води
- •Водневий показник
- •Буферні розчини
- •Індикатори
- •Реакції у розчинах електролітів
- •Гідроліз солей
- •Ступінь гідролізу солі
- •Колоїдні розчини
- •Будова колоїдних часток
- •Окисно-відновні процеси електрохімічні процеси корозія
- •Ступінь окиснення елементу
- •Поняття про окисно-відновні реакції
- •Окисно-відновні властивості речовин
- •Класифікація окисно-відновних реакцій
- •Методи складання рівнянь окисно-відновних реакцій
- •У кислому середовищі:
- •У нейтральному середовищі:
- •В лужному середовищі:
- •Окисно–відновний потенціал
- •Еквівалент окисника і відновника
- •Електродний потенціал
- •Електричного шару
- •Гальванічний елемент
- •Стандартний електродний потенціал
- •Водневий електрод
- •Ряд стандартних електродних потенціалів металів
- •Електроди першого роду
- •Електроди другого роду
- •Окисно-відновні електроди
- •Іонселективні електроди
- •Електроліз
- •Корозія
- •Електрохімічна корозія
- •Захист металів від корозії
- •Загальні властивості полімерів
- •Полімери як високомолекулярні речовини
- •Структура полімерів
- •Реакція полімеризації
- •Механізми полімеризації
- •Властивості полімерів
- •Каучуки
- •Структура каучуків
- •Синтетичні каучуки
- •Вулканізація каучуків
- •Реакція поліконденсації
- •Пластмаси
- •Література для самостійної роботи студентів
Розчини твердих речовин
Способи вираження концентрації розчинів
Процентна концентрація:
 ·100%.
Показує число г речовини в 100 г
розчину.
·100%.
Показує число г речовини в 100 г
розчину.
В частках розчиненої речовини в розчині: масова частка =
 ;
об’ємна частка =
;
об’ємна частка =  ;
мольна часткаN =
;
мольна часткаN =  (n1–
кількість моль розчиненої речовини,
n2
– кількість моль розчинника).
(n1–
кількість моль розчиненої речовини,
n2
– кількість моль розчинника). Молярна концентрація СМ =
 (моль/л).
Показує число моль розчиненої речовини
в 1 л розчину. Часто для позначення
молярної концентрації розчину
використовують літеру М. Наприклад,
0,1 М розчин H2SO4
означає, що в 1 л розчину є 0,1 моль
H2SO4,
що відповідає 9,8 г H2SO4.
(моль/л).
Показує число моль розчиненої речовини
в 1 л розчину. Часто для позначення
молярної концентрації розчину
використовують літеру М. Наприклад,
0,1 М розчин H2SO4
означає, що в 1 л розчину є 0,1 моль
H2SO4,
що відповідає 9,8 г H2SO4.
Нормальна концентрація СN =
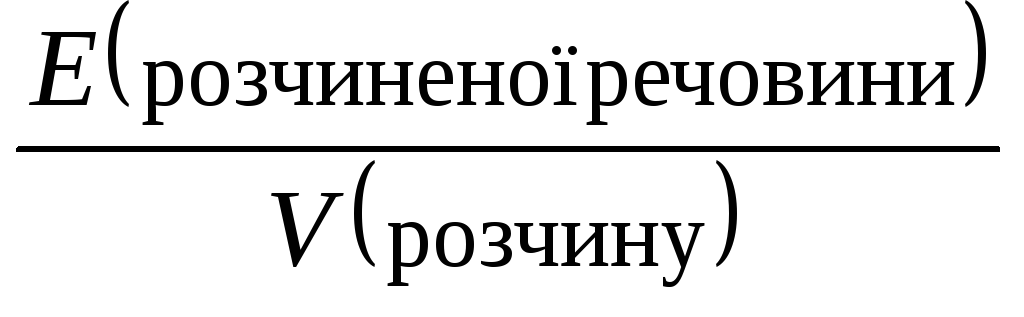 (екв/л). Показує число еквівалентів
розчиненої речовини в 1 л розчину.
Часто для позначення нормальної
концентрації розчину використовують
літеру н. Наприклад, 0,1 н розчин H2SO4
означає, що в 1 л розчину міститься
0,1 еквівалента H2SO4,
що відповідає 4,9 г H2SO4.
Розчинені речовини взаємодіють між
собою в об’ємних співвідношеннях,
обернено пропорційних їх нормальній
концентрації:
(екв/л). Показує число еквівалентів
розчиненої речовини в 1 л розчину.
Часто для позначення нормальної
концентрації розчину використовують
літеру н. Наприклад, 0,1 н розчин H2SO4
означає, що в 1 л розчину міститься
0,1 еквівалента H2SO4,
що відповідає 4,9 г H2SO4.
Розчинені речовини взаємодіють між
собою в об’ємних співвідношеннях,
обернено пропорційних їх нормальній
концентрації:
 абоV1СN1=V2СN2
(наслідок із закону еквівалентів, згідно
з яким речовини взаємодіють між собою
в кількостях, пропорційних їх
еквівалентам). Особливістю еквінормальних
розчинів є те, що їх рівні об’єми
взаємодіють без залишку.
абоV1СN1=V2СN2
(наслідок із закону еквівалентів, згідно
з яким речовини взаємодіють між собою
в кількостях, пропорційних їх
еквівалентам). Особливістю еквінормальних
розчинів є те, що їх рівні об’єми
взаємодіють без залишку.Моляльна концентрація (m) – кількість моль розчиненої речовини в 1 кг розчинника.
Титр (Т) визначається кількістю грамів розчиненої речовини в 1 мл розчину.
Розчини неелетролітів
Осмос
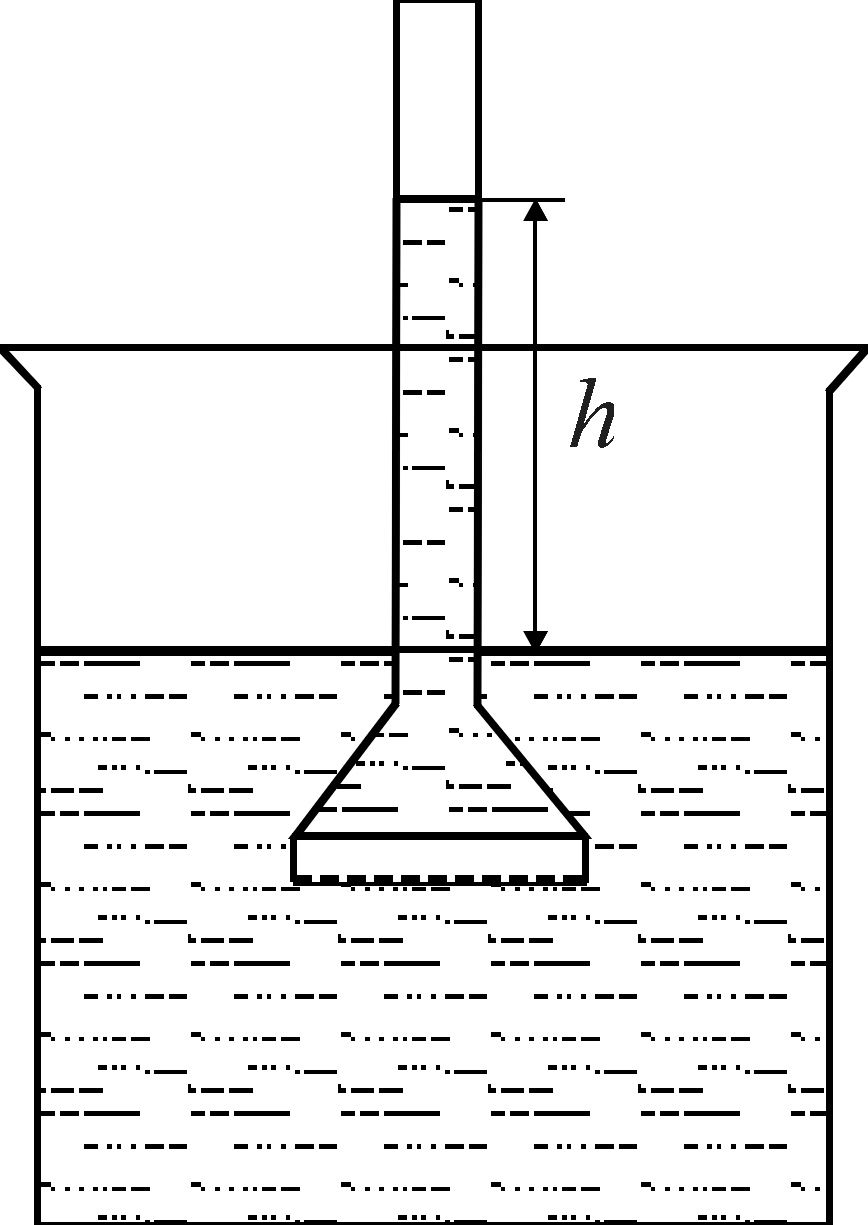
1 Рис.7.
Схема приладу для визначення осмотичного
тиску

У
1886 році Вант-Гофф показав, що осмотичний
тиск розчину чисельно дорівнює тиску,
який чинила би розчинена речовина, якби
вона при даній температурі перебувала
в газоподібному стані і займала об’єм,
що дорівнює об’єму розчину.
Це і є закон
осмотичного тиску:
росм. = ![]() RT,
де n
– число моль розчиненої речовини; V
– об’єм розчину; R
–
універсальна газова стала; T
– температура. Оскільки молярна
концентрація СМ =
RT,
де n
– число моль розчиненої речовини; V
– об’єм розчину; R
–
універсальна газова стала; T
– температура. Оскільки молярна
концентрація СМ = ![]() ,
торосм. = СМRT,
тобто осмотичний тиск розбавленого
розчину прямо пропорційний його молярній
концентрації і температурі. За рівнянням
осмотичного тиску можна обчислити
молекулярні маси М
розчинених речовин. Оскільки CМ =
,
торосм. = СМRT,
тобто осмотичний тиск розбавленого
розчину прямо пропорційний його молярній
концентрації і температурі. За рівнянням
осмотичного тиску можна обчислити
молекулярні маси М
розчинених речовин. Оскільки CМ = ![]() (m
– маса розчиненої речовини в грамах,
що міститься в 1 л розчину), то росм. =
(m
– маса розчиненої речовини в грамах,
що міститься в 1 л розчину), то росм. = ![]() RT,
звідки
RT,
звідки
![]() .
.
Розчини з однаковим осмотичним тиском називають ізотонічними.
