
- •1. Терминология,
- •2. Энергетика процессов
- •3. Критерии направленности процессов и равновесия
- •4. Химическое равновесие
- •1. Терминология, основные понятия и определения
- •1.1. Термодинамическая система
- •1.2. Термодинамические параметры
- •1.3. Термодинамический процесс и термодинамическое равновесие
- •1.4. Функции пути осуществления процесса и функции состояния
- •1.5. Химический процесс и химическая переменная
- •1.6. Модели идеальных систем в химической термодинамике. Реальные системы
- •2. Энергетика процессов
- •2.1. Первое начало термодинамики (постулат о существовании внутренней энергии)
- •2.2. Термодинамическая работа
- •2.3. Внутренняя энергия и теплота
- •2.4. Энтальпия
- •2.5. Взаимосвязь работы и теплоты с изменениями внутренней энергии и энтальпии в изопроцессах с участием идеального газа
- •2.6. Теплоёмкость
- •2.7. Фазовые переходы I рода
- •2.8. Зависимость теплоёмкости от температуры
- •Простых веществ
- •2.9. Зависимость внутренней энергии и энтальпии от температуры
- •2.10. Зависимость внутренней энергии, энтальпии и теплоемкости от давления
- •2.11. Изменение внутренней энергии и энтальпии в химических реакциях
- •2.12. Экспериментальные методы определения тепловых эффектов химических реакций
- •2.13. Стандартные тепловые эффекты
- •2.14. Зависимость теплового эффекта от температуры. Уравнение Кирхгофа
- •Температуры:
- •2.15. Интегрирование уравнения Кирхгофа
- •2.16. Зависимость энтальпии реакции от давления
- •3. Критерии направленности процессов и равновесия в системах постоянного и переменного составов
- •3.1. Второе начало термодинамики (постулат о существовании энтропии)
- •3 .1.1.С в о и ств а энтропии. Энтропия как критерий направленности самопроизвольных процессов и равновесия в изолированных системах
- •3.1.2. Связь энтропии с параметрами
- •3.1.4. Изменение энтропии при обратимых фазовых переходах I рода
- •3.1.5. Статистическое толкование энтропии. Уравнение б ольцма иа -Пл анка
- •3.1.7. Расчет абсолютных значений энтропии
- •Абсолютной энтропии
- •3.1.8. Изменение энтропии в химических
- •3.2. Критерии направленности процессов и равновесия в неизолированных системах
- •3.2.1. Объединенное уравнение первого и второго начал термодинамики
- •3.2.4. Зависимости энергии Гиббса и энергии Гельмгольца от основных параметров состояния
- •Веществ
- •Веществ
- •Веществ
- •Веществ
- •При наличии фазовых превращений
- •3.2.7. Уравнения г и б б с а-г е л ь м г о л ь ц а
- •3.2.8. Вывод уравнений для зависимостей термодинамических функций от давления и объема
- •3.2.9. О "сложности" преобразований при выводе уравнений химической термодинамики
- •Функций по параметрам состояния
- •3.3. Критерии направленности процессов и равновесия в системах переменного состава
- •3.3.1. Химический потенциал
- •3.3.2. Свойства химического потенциала
- •3.3.3. Химический потенциал моля идеального газа
- •3.3.4. Химический потенциал компонента смеси идеальных газов
- •4. Химическое равновесие
- •4.1. Химическое равновесие в смеси идеальных
- •4.2. Расчет стандартного химического сродства
- •4.3. Стандартное химическое сродство и термодинамическая константа равновесия как характеристики равновесного состояния
- •4.4. Химическое сродство как критерий направленности процесса
- •4.5. Зависимость константы равновесия от температуры
- •4.5.1. Дифференциальная форма уравнений изобары и изохоры химической реакции
- •4.6. Расчет термодинамической константы равновесия
- •4.6.1. Общая характеристика фонда справочных данных
- •4.6.2. Способы расчета термодинамической константы равновесия
- •4 . 7 . 1.Реа к ц и и в смесях газов.
- •Связь термодинамической константы равновесия с
- •Эмпирическими (концентрационными) константами
- •Равновесия:Кр', кх,кп,кс
- •4.7.2.Реакции в гомогенной конденсированной фазе (реакции в растворах)
- •4.7.3. Реакции в гетерогенных системах
- •4.8. Расчет состава равновесной смеси по величине термодинамической константы равновесия
- •4.8.1.Химическое превращение представлено единственным уравнением
- •4.8.2.Химическое превращение представлено двумя уравнениями
- •4.8.3. Множественные реакции
- •4.9. Влияние различных факторов на состав
3.1.7. Расчет абсолютных значений энтропии
Прикладное значение постулата Планка состоит в том, что он устанавливает начало отсчета значений энтропии и открывает путь определения абсолютной величины этой термодинамической функции.
Если, например, повышать температуру 1 моля идеального кристалла вещества от 0 до Т при р=1атм, то при отсутствии полиморфных превращений и других изменений фазовых состояний для нахождения энтропии необходимо провести интегрирование уравнения:
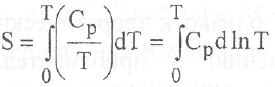
В общем же случае приходится обращаться к более громоздкому выражению:
*) Поскольку, строго говоря, третий закон термодинамики применим только к ограниченному классу веществ, а именно, к чистым бездефектным кристаллам, некоторые авторы (А. Мюстер, Химическая термодинамика, М.: Мир, 1971.—295 с.; с. 196-197,) полагают, что третье начало должно быть сформулировано не в виде закона, а в форме правила, которое на практике "выполняется с достаточной точностью".
74
[p# 75]
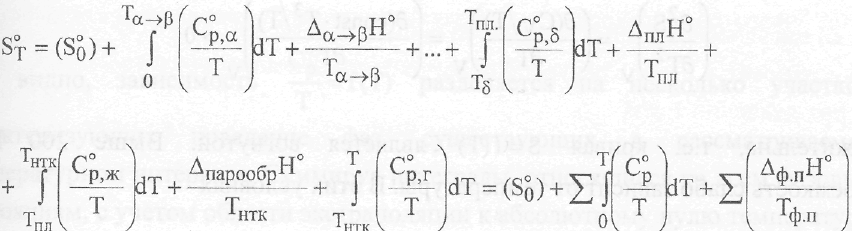
где sq - остаточная или нулевая энтропия; а,р,.,8,... - символы, обозначающие полиморфные модификации кристаллической фазы; Тнтк - нормальная температура кипения.
Графической иллюстрацией записанного выше уравнения являются данные об энтропиях воды и брома, показанные на рис.11 .
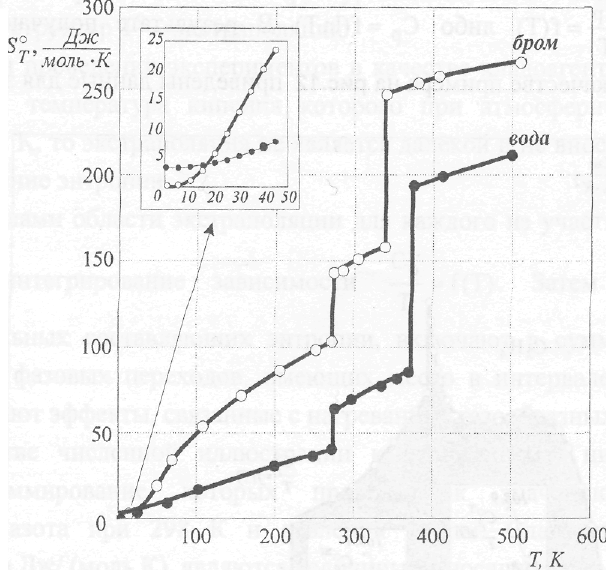
Рис. 11. Температурная зависимость энтропии воды и брома
Как видно из рис.11, зависимость энтропии от температуры имеет сложный характер. В области низких температур, когда теплоемкость возрастает пропорционально температуре в третьей степени, вторая производная энтропии по температуре
3. Критерии (энтропия)
75
[p# 76]
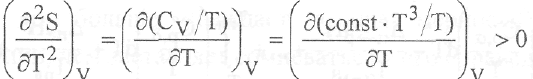
положительна, т.е. кривая S = f (Т) является вогнутой. Выше 200 К теплоемкость слабо зависит от температуры. В этих условиях
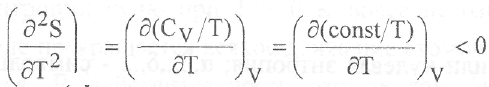
/V
вторая производная отрицательна и наблюдаемая зависимость будет выпуклой. Процедура нахождения абсолютной энтропии веществ основывается на обработке экспериментальных данных о температурной зависимости их теплоемкости. С этой целью массив экспериментальных данных представляют в
Ср координатах —*- = f(T) либо Cp=f(lnT) В результате получают сложную
зависимость. В качестве примера на рис.12 приведены данные для этилена.
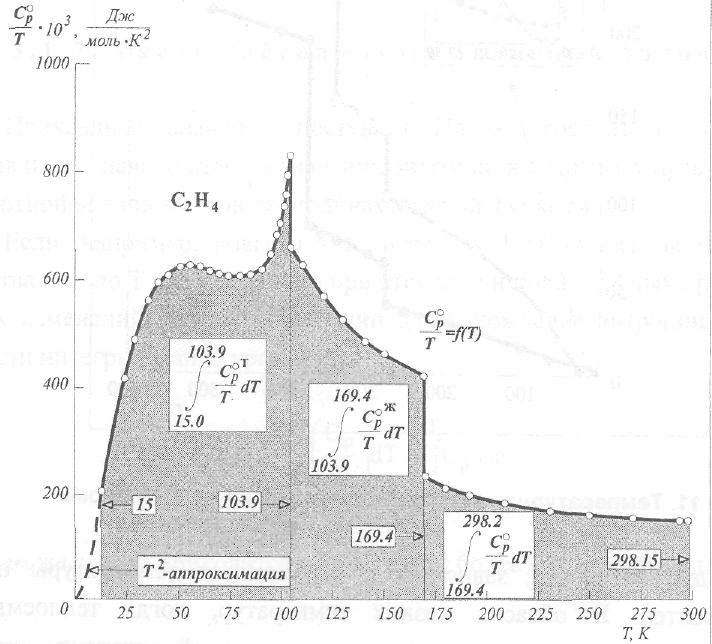
Рис.
12. Интерирование зависимости![]() с
целью нахождения величины
с
целью нахождения величины
м.
Абсолютной энтропии
[p# 77]
76
[p# 78]
с°
V^. rt
Как видно, зависимость —~ = f (Т) разделяется на несколько участков,
характеризующих поведение фаз, существующих в рассматриваемом температурном интервале. Суммируя интегралы, относящиеся ко всем фазовым состояниям, с учетом области экстраполяции к абсолютному нулю температуры и принимая во внимание энтропии всех фазовых переходов, приходим к значению S^gjs-
Современная криогенная техника позволяет производить измерения теплоемкости при весьма низких, но все же отличных от абсолютного нуля температурах. Так как интегрирование должно быть выполнено во всем интервале температур, то всегда существует необходимость экстраполировать данные о теплоемкости к абсолютному нулю температуры. С этой целью в случае трехмерных кристаллических структур используют Т3 - и для слоистых, т.е. двумерных структур Т2 - экстраполяцию.
Если при проведении экспериментов в качестве хладоагента применяют жидкий гелий, температура кипения которого при атмосферном давлении составляет 4,22 К, то экстраполяция не является далёкой и не вносит ощутимой ошибки в значение энтропии.
За пределами области экстраполяции для каждого из участков проводят
С°
D
графическое интегрирование зависимости — = f (Т). Затем суммируют
значения отдельных составляющих энтропии, включают в сумму величины энтропии всех фазовых переходов, имеющих место в интервале температур О - Т, и учитывают эффекты, связанные с нагреванием газообразных веществ
В качестве численной иллюстрации к изложенному, ниже указаны величины, суммирование которых приводит к значению энтропии газообразного азота при 298 К и давлении 1 атм. Слагаемыми суммы, выраженными в Дж/ (моль К), являются величины, относящиеся к:
1) экстраполяции экспериментальных данных от 10 К до О К по
^
уравнению Дебая (Т -экстраполяция) 1,92;
2) графическому интегрированию от 10 К до 35.61 К, что отвечает нагреванию твердого азота до температуры фазового превращения
в твердом состоянии 25,25
энтропии фазового перехода при 35.61 К 6,43;
графическому интегрированию от температуры
фазового перехода до температуры плавления азота при 63.14 К 23,38;
5) энтропии плавления 11,42;
3. Критерии (энтропия) 77
[p# 79]
6) графическому интегрированию в интервале 63.14-77.32 К, которое относится к температурной области существования жидкого
азота при давлении 1 атм 11,41;
энтропии парообразования при нормальной температуре кипения 72,13;
изобарическому нагреванию азота как идеального газа в интервале 77.32-298.15 К 39.20;
поправки на неидеальность поведения газа 0,92 .
В результате получаем S^g = 192.06 Дж/(моль-К).
Измерения низкотемпературной теплоёмкости очень трудоемки, поэтому массив справочных данных о величинах абсолютных энтропии веществ значительно меньше, чем по стандартным энтальпиям образования.
В некоторых справочных руководствах наряду с данными о S^g (будьте
внимательны: это именно абсолютная энтропия, но не AfS^g) приводятся сведения о высокотемпературных составляющих энтропии Sj - 8298 • Последнее избавляет от необходимости интегрирования в интервале температур 298 - Т и открывает возможность расчета Sj по уравнению:
![]()
Если требуется рассчитать величину мольной энтропии при давлении, отличном от стандартного, то вычисления проводят по уравнению*):
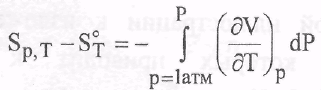
•
*) Вывод уравнения дан в разделе 3.2.8.
3. Критерии (энтропия) 78
Как уже отмечалось, для конденсированных фаз влиянием давления на величину энтропии можно пренебречь. В случае идеальных газов расчет осуществляют по уравнению:
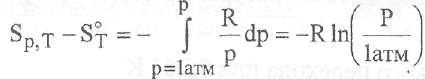
[p# 80]
Для вычисления энтропии реальных газов необходимо знать
fdV] соответствующее уравнение состояния и, представив — как функцию
давления, взять интеграл, приведенный выше.
Так как данные об абсолютных энтропиях конденсированных фаз сравнительно (с информацией о стандартных энтальпиях образования) немногочисленны, полезно принять во внимание эмпирическое уравнение Веннера, позволяющее оценить или уточнить сомнительное по тем или иным причинам значение энтропии. Это уравнение, справедливое для ряда однотипных неорганических веществ, имеет вид:
S = AlgM + B,
где М - - молярная масса соединения, А и В - эмпирические константы, характеризующие рассматриваемый ряд веществ.
Отметим здесь же, что для газообразных веществ, состояние которых близко к идеальному, значения энтропии при любых температурах и давлениях могут быть вычислены методами статистической термодинамики из данных о пространственном строении молекулы и величинах ее молекулярных постоянных. Соответствующие уравнения будут выведены при рассмотрении свойств идеальных газов.
