
- •1. Терминология,
- •2. Энергетика процессов
- •3. Критерии направленности процессов и равновесия
- •4. Химическое равновесие
- •1. Терминология, основные понятия и определения
- •1.1. Термодинамическая система
- •1.2. Термодинамические параметры
- •1.3. Термодинамический процесс и термодинамическое равновесие
- •1.4. Функции пути осуществления процесса и функции состояния
- •1.5. Химический процесс и химическая переменная
- •1.6. Модели идеальных систем в химической термодинамике. Реальные системы
- •2. Энергетика процессов
- •2.1. Первое начало термодинамики (постулат о существовании внутренней энергии)
- •2.2. Термодинамическая работа
- •2.3. Внутренняя энергия и теплота
- •2.4. Энтальпия
- •2.5. Взаимосвязь работы и теплоты с изменениями внутренней энергии и энтальпии в изопроцессах с участием идеального газа
- •2.6. Теплоёмкость
- •2.7. Фазовые переходы I рода
- •2.8. Зависимость теплоёмкости от температуры
- •Простых веществ
- •2.9. Зависимость внутренней энергии и энтальпии от температуры
- •2.10. Зависимость внутренней энергии, энтальпии и теплоемкости от давления
- •2.11. Изменение внутренней энергии и энтальпии в химических реакциях
- •2.12. Экспериментальные методы определения тепловых эффектов химических реакций
- •2.13. Стандартные тепловые эффекты
- •2.14. Зависимость теплового эффекта от температуры. Уравнение Кирхгофа
- •Температуры:
- •2.15. Интегрирование уравнения Кирхгофа
- •2.16. Зависимость энтальпии реакции от давления
- •3. Критерии направленности процессов и равновесия в системах постоянного и переменного составов
- •3.1. Второе начало термодинамики (постулат о существовании энтропии)
- •3 .1.1.С в о и ств а энтропии. Энтропия как критерий направленности самопроизвольных процессов и равновесия в изолированных системах
- •3.1.2. Связь энтропии с параметрами
- •3.1.4. Изменение энтропии при обратимых фазовых переходах I рода
- •3.1.5. Статистическое толкование энтропии. Уравнение б ольцма иа -Пл анка
- •3.1.7. Расчет абсолютных значений энтропии
- •Абсолютной энтропии
- •3.1.8. Изменение энтропии в химических
- •3.2. Критерии направленности процессов и равновесия в неизолированных системах
- •3.2.1. Объединенное уравнение первого и второго начал термодинамики
- •3.2.4. Зависимости энергии Гиббса и энергии Гельмгольца от основных параметров состояния
- •Веществ
- •Веществ
- •Веществ
- •Веществ
- •При наличии фазовых превращений
- •3.2.7. Уравнения г и б б с а-г е л ь м г о л ь ц а
- •3.2.8. Вывод уравнений для зависимостей термодинамических функций от давления и объема
- •3.2.9. О "сложности" преобразований при выводе уравнений химической термодинамики
- •Функций по параметрам состояния
- •3.3. Критерии направленности процессов и равновесия в системах переменного состава
- •3.3.1. Химический потенциал
- •3.3.2. Свойства химического потенциала
- •3.3.3. Химический потенциал моля идеального газа
- •3.3.4. Химический потенциал компонента смеси идеальных газов
- •4. Химическое равновесие
- •4.1. Химическое равновесие в смеси идеальных
- •4.2. Расчет стандартного химического сродства
- •4.3. Стандартное химическое сродство и термодинамическая константа равновесия как характеристики равновесного состояния
- •4.4. Химическое сродство как критерий направленности процесса
- •4.5. Зависимость константы равновесия от температуры
- •4.5.1. Дифференциальная форма уравнений изобары и изохоры химической реакции
- •4.6. Расчет термодинамической константы равновесия
- •4.6.1. Общая характеристика фонда справочных данных
- •4.6.2. Способы расчета термодинамической константы равновесия
- •4 . 7 . 1.Реа к ц и и в смесях газов.
- •Связь термодинамической константы равновесия с
- •Эмпирическими (концентрационными) константами
- •Равновесия:Кр', кх,кп,кс
- •4.7.2.Реакции в гомогенной конденсированной фазе (реакции в растворах)
- •4.7.3. Реакции в гетерогенных системах
- •4.8. Расчет состава равновесной смеси по величине термодинамической константы равновесия
- •4.8.1.Химическое превращение представлено единственным уравнением
- •4.8.2.Химическое превращение представлено двумя уравнениями
- •4.8.3. Множественные реакции
- •4.9. Влияние различных факторов на состав
3 .1.1.С в о и ств а энтропии. Энтропия как критерий направленности самопроизвольных процессов и равновесия в изолированных системах
Энтропия является экстенсивным свойством вещества и аддитивным свойством сложной системы, включающей несколько веществ или подсистем. Это означает, что энтропия пропорциональна массе (числу молей) вещества "i" и при наличии в системе нескольких веществ находится суммированием произведения мольной энтропии на число молей данного вещества:
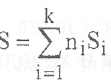
Размерность энтропии Дж/К совпадает с размерностью теплоемкости. Величину энтропии принято относить к молю вещества, что приводит к Дж/( моль К).
В случае изолированных систем, для которых исключён обмен с окружающей средой массой и любыми видами энергии, можно записать:
![]()
откуда следует, что
энтропия изолированной системы или увеличивается, или после достижения максимума остается постоянной.
Графически это поясняет рис.10 .
64
[p# 71]

Рис.10, Изменения энтропии изолированной системы
Если изолированная система достигла состояния равновесия, то изменить его можно только при условии отмены ограничения, исключающего возможность обмена энергией с окружающей средой. В неизолированных системах, для которых обмен энергией и массой имеет место, знак изменения энтропии системы может быть как больше, так и меньше нуля.
3.1.2. Связь энтропии с параметрами
состояния(Т,р,У) в процессах с участием идеальных газов
Для систем, в которых осуществляются обратимые превращения в условиях постоянства объема или давления можно записать:
![]()
Так как
![]()
то

Поскольку теплоемкость индивидуальных веществ является величиной
3. Критерии (энтропия)
65
[p# 72]
положительной, то энтропия вещества должна всегда возрастать с повышением температуры.
Для идеальных газов интегрирование записанных уравнений приводит к выражениям, описывающим изменение энтропии в процессах:
2) изохорного нагревания
1) изобарного нагревания:

![]()
![]()
где п - число молей газа, участвующих в процессе.
Остановимся теперь на анализе зависимостей энтропии от объема и давления при фиксированной температуре. Рассмотрим на данном этапе эти зависимости применительно к описанию поведения идеального газа*). Как уже отмечалось, для обратимых процессов
![]()
Поскольку
![]()
то для процессов с участием моля идеального газа при постоянстве температуры и давления будем иметь
pdV=TdS и, следовательно
*) В общем виде эти уравнения будут выведены в разделе 3.2.8 и имеют вид:
![]()
[p# 73]
После
разделения переменных и интегрирования
в пределах V:
и V2
получаем:
![]()
![]()
Отсюда следует, что энтропия газа возрастает с увеличением объема и уменьшается при возрастании давления. Это вполне понятно в терминах молекулярной упорядоченности системы. Действительно, чем меньший объем занимает газ, тем меньше становятся межмолекулярные расстояния и тем сильнее возрастает упорядоченность системы. В пределе может произойти конденсация газа с образованием жидкости. Жидкости и твердые тела являются упорядоченными структурами и в отличие от газов практически несжимаемы. Поэтому энтропия конденсированных фаз очень слабо зависит от давления,
В случае, если в ходе процесса изменяются два параметра состояния одновременно, например, газ расширяется и нагревается, переходя из состояния Vj,T] в состояние V2,T2> то, учитывая независимость изменения энтропии от
пути процесса, результат можно представить как сумму изменений на этапах изохорического нагревания и изотермического расширения или же наоборот;
![]()
3.1.3. Изменение энтропии при смешивании идеальных газов (p,T=const)
Типичным примером самопроизвольно протекающего процесса является смешивание газов. Согласно второму началу термодинамики энтропия системы должна при этом возрастать. Убедимся в этом. Представим, что в двух сосудах, соединенных невесомой перегородкой, находятся два невзаимодействующих газа ("1" и "2"). Пусть объемы сосудов и числа молей газов составляют, соответственно, V^niHV^,!^.
3. Критерии (энтропия) 67
Изменение энтропии при смешивании можно представить как сумму двух процессов изотермического расширения
![]()
[p# 74]
Так как
![]()
то энтропия системы при смешивании должна возрасти. Поскольку:
*
![]()
где х, - мольная доля газа "1" в получаемой смеси, то уравнение для изменения энтропии может быть представлено в более удобной форме:
![]()
После деления на общее число молей компонентов, образующих смесь ^Гп; изменение энтропии будет отнесено к одному молю смеси, и в этом случае
![]()
Вывод о самопроизвольном возрастании энтропии при смешивании газов равноценен заключению о спонтанном загрязнении веществ при их синтезе.
