
- •Билет 1.
- •1. Активность, коэффициент активности и способы их определения. Ограниченная и полная взаимная растворимость компонентов в различных фазовых состояниях. Диаграммы состояния.
- •2. Соли. Соли кислородсодержащих и бескислородных кислот. Склонность элементов к вхождение в состав солей в катионной и анионной формах в зависимости от природы элемента и степени окисления.
- •3. Сложные эфиры. Реакции этерификации и гидролиза сложных эфиров, их механизм. Жиры, их состав. Гидрирование и гидролиз жиров.
- •Билет №2
- •1. Ковалентная связь. Квантово-химическая трактовка природы химических связей и строения молекулы. Химическая связь в молекуле водорода.
- •2. Хроматография. Принципы хроматографического разделения. Параметры хроматограмм. Газовая, жидкостная и сверхкритическая флюидная хроматография.
- •ГомоПк.
- •Билет №3.
- •1. Основные положения теорий валентных связей и молекулярных орбиталей. Их сравнительные возможности.
- •2. Электроанализ: потенциометрия, вольтамперометрия, кулонометрия.
- •3. Радикальная, катионная, анионная полимеризация.
- •Билет 4.
- •1.Концепция гибридизации атомных орбиталей. Концепция отталкивания электронных пар. Простанственная конфигурация молекул и ионов.
- •2. Простые вещества, образуемые р-элементами. Аллотропия и полиморфизм. Химические свойства галогенов, кислорода, озона, халькогенов, азота, фосфора, углерода, кремния.
- •3. Нитросоединения. Способы получения и важнейшие свойства.
- •Билет 5
- •1. Нефть, её состав и переработка. Особенности строения и химический состав циклоалканов.
- •2. Спектральные методы анализа и исследования, люминесцентный, эпр- и ямр-спектроскопия.
- •3. Количественные характеристики химической связи: порядок, энергия, длина, степень ионности, дипольный момент, валентный угол.
- •Билет №6.
- •1. Трактовка ионной связи на основе электростатических представлений.
- •2. Оптические методы анализа. Атомно-эмиссионный, атомно-абсорбционный и молекулярно-абсорбционный анализ, реагенты и реакции в фотометрическом анализе. Экстракционно-фотометрический анализ.
- •3. Алкены, методы синтеза и общие представленияо реакционной способности. Присоединение электрофильных реагентов реагентов по двойной связи.
- •Билет №7
- •1. Типы координационной связи (особенности химической связи в комплексных соединениях). Донорно-акцепторный и дативный механизм ее образования.
- •2. Основные различия между нмс и вмс.
- •3. Сульфидный, кислотно-щелочной, аммиачно-фосфатный методы разделения катионов.
- •Билет № 8.
- •1. Метод валентных связей и его недостатки в применении к координационным соединениям. Теория кристаллического поля и мо в применении к комплексным соединениям.
- •2. Экстракционные и сорбционные методы разделения и концентрирования. Факторы, определяющие межфазный перенос компонентов в экстракции и сорбционных системах.
- •Билет №9
- •1. Методы исследования и способы описания геометрических параметров молекулы. Симметрия молекул. Основные виды изомерии молекул и принципы динамической стереохимии
- •2. Простые и комплексные соли. Кристаллогидраты. Гидролиз солей.
- •3. Алкадиены. Сопряженные диены, особенности их строения и свойств. Каучуки.
- •Билет 10.
- •1.Силы Ван-дер-Ваальса. Водородная связь.
- •2. Титриметрия. Кислотно-основное, комплексонометрическое и электрохимическое титрование. Кривые титрования. Индикаторы.
- •3. Алкины. Методы синтеза и важнейшие свойства алкинов. Ацетилен.
- •Билет 11
- •1. Энергетические параметры молекул. Понятие об энергии образования молекул. Энергетические состояния: вращательные, электронные и колебательные спектры молекул.
- •3. Ароматические углеводороды. Промышленное источники аренов, их химические свойства и применение. Механизм и закономерности реакций электрофильного замещения в ароматическом ядре.
- •Билет 12
- •1. Магнитные свойства молекул. Спектры электронного парамагнитного резонанса и ямр спектры. Принципы и возможности исследования структуры и свойств молекул.
- •4. Активация галогенпроизводных и генерация карбокатионов.
- •Билет 13
- •1. Основы тд анализа хим процессов. Постулаты и законы хим тд. Функция состояния: температура, внутр энергия, энтальпия, энтропия, энергии Гиббса и Гельмгольца.
- •2. Особенности свойств р-элементов II и V периодов.
- •3. Спирты и фенолы. Методы получения и сравнительная характеристика хим св-в. Этиленгликоль. Глицерин. Лавсан.
- •14 Билет
- •1.Условия равновесия и критерии самопроизвольного протекания процессов, выраженные через характеристические функции.
- •3.Особенности реакционной способности арилгалогенидов. Получение литий- и магнийорганических соединений, их применение в органическом синтезе.
- •Билет №15
- •1. Энергетика химических реакций, основные законы термохимии и термохимические расчеты.
- •2. Особенности изменения химических свойств d-элементов по группам и периодам по сравнению с p-элементами. Образование катионных и анионных форм, комплексообразование.
- •3. Фенолформальдегидные смолы. Простые эфиры. Методы синтеза и свойства. Диэтиловый эфир.
- •Билет 16
- •2. Гидриды. Типы гидридов: солеобразные, полимерные, летучие, гидриды внедрения. Типичные примеры и общая характеристика свойств каждой группы гидридов. Гидрокомплексы.
- •3. Правило Марковникова и его интерпретация. Реакция по аллильному положению.
- •Билет 17
- •1. Основные типы химической связи: ковалентная, ионная, металлическая. Многоцентровая, σ и π-связи
- •2. Гравиметрия. Варианты гравиметрии: осаждение, отгонка, выделение. Термогравиметрия. Реагенты-осадители: минеральные, органические.
- •3. Альдегиды и кетоны. Методы получения представителей, их свойства
- •Билет 18
- •1. Коллоидное состояние вещества. Особенности свойств дисперсных систем и их классификация. Получение и молекулярно-кинетические свойства дисперсных систем, их устойчивость.
- •2. Гидроксиды. Типы гидроксидов: гидроксиды с ионной, молекулярной, полимерной структурой.
- •3. Енолизация альдегидов и кетонов. Альдольная конденсация и родственные процессы. Реакции альдегидов и кетонов с гетероатомными нуклеофилами. Альфа-бета-непредельные карбинильные соединения.
- •Билет 19
- •2. Периодичность изменения хим св-в э-тов и образуемых ими соединений. Валентность и степень окисления.
- •3. Углеводы. Важнейшие представители моносахаридов, их строение и важнейшие свойства. Дисахариды и полисахариды, сахароза, крахмал, целлюлоза.
- •-Рибоза -дезоксирибоза Рибоза и дезоксирибоза входят в сотав рнк и днк соответственно. Основные реакции моносахаридов, продукты реакций и их свойства
- •Билет №20
- •1. Влияние температуры на скорость химической реакции. Уравнение Аррениуса, понятие об энергии активации и методах ее определения.
- •3. Карбоновые кислоты и их производные. Методы синтеза, взаимные превращения.
- •Билет №21.
- •3. Углеводороды. Алканы. Конформационная изомерия. Важнейшие свободнорадикальные реакции алканов.
- •Билет 22
- •1. Понятие о катализе и катализаторах. Гомогенный и гетерогенный катализ. Энергетические профили каталитических реакций. Основы теории гетерогенного катализа.
- •2. Комплексные соединения. Типичные комплексообразователи и лиганды. Пространственная конфигурация комплексных ионов. Особенности диссоциации комплексных соединений в растворе. Карбонилы металлов.
- •3. Амины. Типы аминов и их свойства. Особенности свойств ароматических аминов. Реакция диазотирования и её значение в органическом синтезе.
- •Билет 23
- •2. Радиоактивационный анализ. Масс-спектральный анализ. Рентгеновская фотоэлектронная спектроскопия. Инфракрасная спектроскопия.
- •3. Гетероциклические соединения, общие принципы их классификации. Важнейшие пятичленные и шестичленные, гетероароматические соединения с одним гетероатомом. Особенности их химических свойств.
- •Билет №24
- •1.Равновесные электродные процессы. Понятие о скачке потенциала на границе раздела фаз. Электрохимический потенциал. Образование и строение двойного электрического слоя.
- •2. Оксиды. Типы оксидов: оксиды с ионной, молекулярной и полимерной структурой.
- •Билет 25
- •3. Декструкция высокомолекулярных соединений. Сшивание высокомолекулярных соединений. Синтез и свойства привитых сополимеров.
3. Углеводы. Важнейшие представители моносахаридов, их строение и важнейшие свойства. Дисахариды и полисахариды, сахароза, крахмал, целлюлоза.
Углеводы широко распространены в животном и растительном мире, они играют исключительную роль во многих процессах. Они являются одним из главных пищевых продуктов и служат исходным в-вом для промышленного производства искусственного волокна, взрывчатых веществ, бумаги и этилового спирта.
Моносахариды глюкоза, фруктоза, рибоза.
Глюкоза может существовать в 3-х изомерных формах, две из которых циклические и одна альдегидная. В растворе все они в равновесии, и альдегидная в наименьшем количестве.

![]() -глюкоза
-глюкоза
![]() -глюкоза
фруктоза
-глюкоза
фруктоза
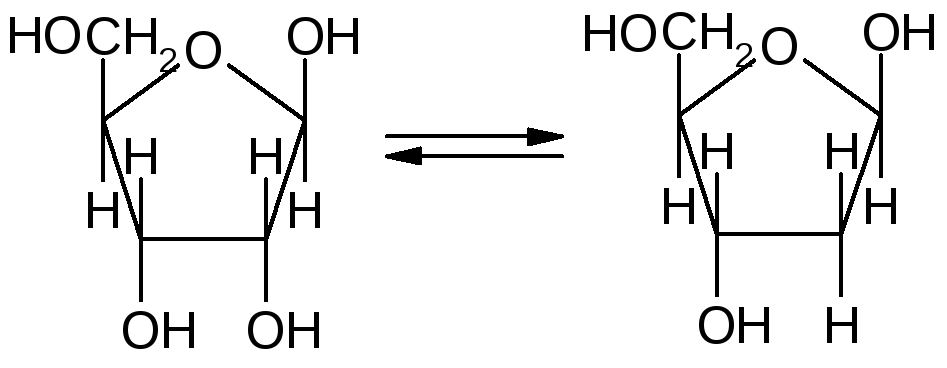
-Рибоза -дезоксирибоза Рибоза и дезоксирибоза входят в сотав рнк и днк соответственно. Основные реакции моносахаридов, продукты реакций и их свойства
Реакции полуацетального гидроксила. Уже отмечалось, что моносахариды как в кристаллическом состоянии, так и в растворе в основном существуют в полуацетальных формах. Полуацетальный гидроксил отличается большей реакционной способностью и может замещаться другими группировками в реакциях со спиртами, карбоновыми кислотами, фенолами и т.д.

α-D-глюкоза: а - линейная формула глюкозы (альдогексоза); б - структурная формула по Хеуорсу; в - конформаци-онная формула (форма кресла).
Продукт реакции называют гликозидом. Соответственно α- и β-изоме-рам моносахаридов существуют α- и β-глюкозиды. Например, при реакции метилового спирта с глюкозой (допустим, в β-пиранозной форме) в присутствии неорганических кислот образуется продукт алкилирования ме-тил-β-D-глюкопиранозид:

При действии на β-D-глюкопиранозу уксусной кислотой образуется продукт ацилирования ацетил-β-D-глюкопиранозид:

Ацилированию и метилированию способны подвергаться и остальные группы моносахаридов, но при намного более жестких условиях.
Реакции с участием карбонильной группы. Линейная форма в кристаллических препаратах моносахаридов и их растворах присутствует в незначительных количествах, но ее участие в таутомерном равновесии обеспечивает моносахаридам все свойства, присущие альдегидам (в альдозах) или кетонам (в кетозах). Способность альдоз и кетоз присоединять спирты представлена ранее.
Рассмотрим некоторые другие их свойства.
Окисление моносахаридов. Обработка альдоз слабыми окислителями приводит к превращению альдегидной группы в положении атома С-1 в карбоксильную группу с образованием так называемых альдоновых кислот. Альдоновой кислотой может быть D-глюконовая кислота, которая образуется при окислении альдегидной группы D-глюкозы. Фосфорилированная форма D-глюконовой кислоты играет важную роль в качестве промежуточного продукта углеводного обмена. Другой пример – D-галактоновая кислота – продукт окисления альдегидной группы D-галактозы.

В альдуроновых, или уроновых, кислотах окислена (с образованием карбоксильной группы) первичная спиртовая группа, а альдегидная группа остается неокислен-ной. Уроновая кислота, образующаяся из D-глюкозы, носит название D-глюку-роновой кислоты, а образующаяся из D-галактозы – D-галактоуроновой кислоты.
Уроновые кислоты весьма важны в биологическом отношении, многие из них являются компонентами полисахаридов.

Восстановление моносахаридов. Моносахариды легко гидрируются по связи С—О и при этом превращаются в многоатомные спирты (сахароспирты). D-глюкоза, например, образует спирт сорбит, а D-манноза – маннит. Восстановление D-фруктозы приводит к эквимолекулярной смеси эпимеров – D-маннита и D-cop-бита, так как в результате гидрирования второй атом углерода становится асимметричным. Такого рода восстановление может осуществляться и ферментативным путем.
ещё брожение, с дрожжами до спитра, с ферментами масляно и молочно кислое
Дисахариды

Дисахариды образуются из 2 молекул моносахаридов путём межмолек дегидратации. При гидролизе в килотной среде сахароза вновь переходит в моносахариды.
Полисахариды
Макромолекулы крахмала построены из большого числа остатков α-глюкозы. Это аморфный порошок белого цвета, без вкуса и запаха, в гор воде обр коллоидный раствор

Молекулы целлюлозы это длинные цепи состоящие из остатков β-глюкозы
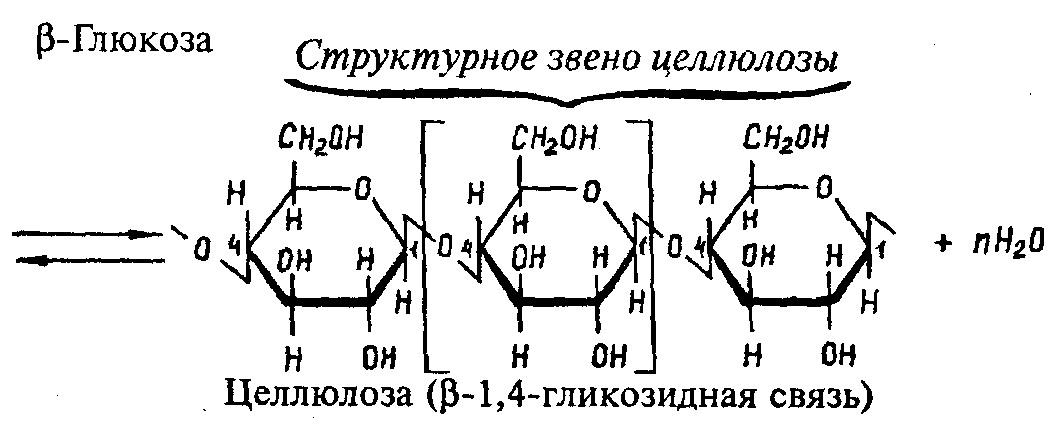
Каждое структурное звено целлюлозы содержит три свободных гидроксила, по этим гидроксилам она может нитроваться с образованием моно, би и тринитрата(порох) целлюлозы. С уксусной кислотой образуются моно, би и триацетаты. Из триацетата делают ацетатное волокно.
