
Небулайзерная терапия Metodichka_Avdeev
.pdf
ФГУ «Научно-исследовательский институт пульмонологии» ФМБА, Москва
С.Н. Авдеев
Небулайзерная терапия суспензией Пульмикорта: место в лечении заболеваний дыхательных путей
Методическое пособие для врачей (издание 2-е, переработанное и дополненное)
Москва 2008

ВВЕДЕНИЕ
Небулайзерная терапия суспензией Пульмикорта: место в лечении заболеваний дыхательных путей
Методическое пособие разработано руководителем клинического отдела ФГУ НИИ пульмонологии ФМБА, профессором, доктором медицинских наук АВДЕЕВЫМ Сергеем Николаевичем
Пособие предназначено для пульмонологов, аллергологов, врачей-терапевтов, специалистов по интенсивной терапии.
Оглавление
ВВЕДЕНИЕ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
ВЫБОР ОПТИМАЛЬНОГО УСТРОЙСТВА ДОСТАВКИ |
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
Показания для применения небулайзеров |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Устройство и принцип действия |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Струйные небулайзеры |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Ультразвуковые небулайзеры |
|
|
|
|
8 |
|||||||||||||||||||
|
|
|
|
|||||||||||||||||||||
Мембранные небулайзеры |
|
|
|
|
9 |
|||||||||||||||||||
|
|
|
|
|||||||||||||||||||||
Особенности использования Пульмикорта Суспензии для небулайзеров |
|
|
|
|
11 |
|||||||||||||||||||
|
|
|
|
|||||||||||||||||||||
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА БУДЕСОНИДА |
|
|
|
12 |
||||||||||||||||||||
|
|
|
||||||||||||||||||||||
НЕБУЛИЗИРОВАННЫЙ ПУЛЬМИКОРТ ПРИ СТАБИЛЬНОМ ТЕЧЕНИИ БРОНХИАЛЬНОЙ АСТМЫ И |
|
|
||||||||||||||||||||||
ХОБЛ |
|
|
|
|
14 |
|||||||||||||||||||
|
|
|
|
|||||||||||||||||||||
Небулизированный Пульмикорт у пожилых больных с БА и ХОБЛ |
|
|
|
|
|
|
|
14 |
||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||
Небулизированный Пульмикорт при стероидо-зависимой астме |
|
|
|
|
|
|
|
15 |
||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||
Небулизированный Пульмикорт при неконтролируемой бронхиальной астме |
|
|
18 |
|||||||||||||||||||||
|
|
|||||||||||||||||||||||
НЕБУЛИЗИРОВАННЫЙ ПУЛЬМИКОРТ ПРИ ОБОСТРЕНИЯХ БРОНХИАЛЬНОЙ АСТМЫ И ХОБЛ |
|
|
19 |
|||||||||||||||||||||
|
|
|||||||||||||||||||||||
Роль ГКС при обострениях бронхиальной астмы и ХОБЛ |
|
|
|
|
|
|
|
|
|
19 |
||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||
Более высокая безопасность иГКС по сравнению с системными ГКС |
|
|
19 |
|||||||||||||||||||||
|
|
|||||||||||||||||||||||
Более быстрый эффект иГКС по сравнению с системными ГКС |
|
|
|
|
|
|
20 |
|||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||
Небулайзерная терапия Пульмикортом при обострении бронхиальной астмы |
|
|
22 |
|||||||||||||||||||||
|
|
|||||||||||||||||||||||
Небулайзерная терапия Пульмикортом при обострении ХОБЛ |
|
|
|
|
|
|
28 |
|||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||
ДРУГИЕ ВОЗМОЖНЫЕ ОБЛАСТИ ИСПОЛЬЗОВАНИЯ ПУЛЬМИКОРТА |
|
|
33 |
|||||||||||||||||||||
|
|
|||||||||||||||||||||||
ПОБОЧНЫЕ ЭФФЕКТЫ НЕБУЛИЗИРОВАННОГО ПУЛЬМИКОРТА |
|
|
|
|
|
34 |
||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПРИ ИСПОЛЬЗОВАНИИ ПУЛЬМИКОРТА |
|
|
35 |
|||||||||||||||||||||
|
|
|||||||||||||||||||||||
ЛИТЕРАТУРА |
|
|
|
|
|
|
|
38 |
||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||
2
Основным способом доставки ингаляционных глюкокортикостероидов (ГКС) в дыхательные пути больного являются дозированные ингаляторы (со спейсерами или без них) и порошковые ингаляторы. Однако существуют такие больные с заболеваниями дыхательных путей, которые либо не способны использовать портативные типы устройств доставки, либо у которых терапия ингаляционными глюкокортикостероидами (иГКС) в максимальных дозах не приносит должного эффекта. Такие больные для контроля заболевания вынуждены прибегать к использованию системных ГКС, что неизбежно сопровождается тяжелыми побочными реакциями. Относительно недавно появилась важная альтернатива системным стероидам – доставка иГКС в дыхательные пути больного при помощи небулайзера. Достоинствами небулайзерной терапии является возможность доставки большой дозы препарата, отсутствие необходимости выполнения форсированных маневров и четкой координации вдоха с высвобождением препарата, т.е. использование небулайзера возможно в ситуациях, когда тяжесть состояния пациента, его возраст и его низкая кооперация не позволяют правильно использовать другие ингаляторы [Авдеев, 2001]. Одно из первых исследований, посвященных использованию небулизованного будесонида (Пульмикорта), показало его высокую эффективность у больного с тяжелой стероидо-зависимой бронхиальной астмой [Godfrey et al., 1987]. В течение последующих 20 лет в мире накоплен значительный опыт использования небулайзерной терапии иГКС при тяжелых заболеваниях дыхательных путей у взрослых и детей, при острых и хронических состояниях.
ВРоссии,какивбольшинствестранмира,основнымиГКС,использующимсядлянебулизации, является будесонид (Пульмикорт ТМ, суспензия для ингаляций, AstraZeneca).
Показания к терапии иГКС при помощи небулайзера можно представить следующим образом:
Обструктивные заболевания дыхательных путей у детей (бронхиальная астма, бронхиолит, бронхолегочная дисплазия, муковисцидоз), не способных использовать другие устройства доставки аэрозоля;
Обструктивные заболевания дыхательных путей у пожилых (бронхиальная астма, хроническая обструктивная болезнь легких), не способных использовать другие устройства доставки аэрозоля;
Тяжелая стероидо-зависимая бронхиальная астма у детей и взрослых, как альтернатива системным стероидам;
Плохо контролируемая бронхиальная астма;
Обострение бронхиальной астмы у детей и взрослых, как альтернатива системным стероидам;
Обострение хронической обструктивной болезни легких, как альтернатива системным стероидам;
Заболевания дыхательных путей у больных любого возраста, неспособных к правильному использованию портативных устройств доставки аэрозоля.
Высокая эффективность и безопасность терапии небулизированным Пульмикортом при хронической БА у детей была продемонстрирована в пяти крупных рандомизированных контролируемых исследованиях, включавших, в общей сложности, 1748 детей в возрасте от 6 месяцев до 8
лет [Baker et al, 1999; Kemp et al, 1999; Shapiro et al, 1998; Murphy et al., 2002; Szefler et al, 2007].
Настоящее пособие посвящено проблемам применения небулизированного Пульмикорта у взрослых больных с заболеваниями дыхательных путей.
3

ВЫБОР ОПТИМАЛЬНОГО УСТРОЙСТВА ДОСТАВКИ
Эффективность терапии иГКС зависит не только от их химической структуры, но и от вида устройства доставки аэрозоля в дыхательные пути. Идеальное устройство доставки должно обеспечивать депозицию большой фракции препарата в легких, быть достаточно простым в использовании, надежным, и быть доступным для применения в любом возрасте и при тяжелых стадиях заболевания.
Показания для применения небулайзеров
Абсолютных показаний к применению небулайзеров относительно немного, они должны использоваться, когда [Muers, 1997]:
1)лекарственное вещество не может быть доставлено в дыхательные пути при помощи других ингаляторов, т.к. существует достаточно много лекарственных препаратов, для которых не создано портативных ингаляторов (дозированных ингаляторов, порошковых ингаляторов): антибиотики, муколитики, препараты сурфактанта, анестетики и др.
2)необходима доставка препарата в альвеолы (например, препараты сурфактанта при синдроме острого повреждения легких);
3)тяжесть состояния пациента или его физическое состояние не позволяют правильно использовать портативные ингаляторы. Данное показание является наиболее важным и наиболее значимым при выборе ингаляционной техники. Несмотря на известные достоинства дозированных ингаляторов (малые размеры, более низкая стоимость, быстрота использования), их использование требует четкой координации между вдохом больного и высвобождением лекарственного препарата, а также форсированного маневра. Пожилой возраст больного часто является препятствием для правильного использования всех видов ингаляционной техники, кроме небулайзера. Небулайзер является также единственно возможным средством доставки аэрозольных препаратов у детей до 3 лет.
К объективным критериям, требующим назначения ингаляций при помощи небулайзеров, относят: снижение инспираторной жизненной емкости менее 10,5 мл/кг веса (например, < 735 мл у больного массой 70 кг); инспираторный поток больного менее 30 л/мин; неспособность задержки дыхания более 4 секунд; кроме того, использование небулайзеров показано больным с двигательными расстройствами, нарушением уровня сознания [O’Donohue, 1996].
Все остальные показания являются относительными (т.е. в данных ситуациях небулайзер можно заменить другими ингаляционными системами):
1)необходимость использования большой дозы препарата. Дозы лекарственных препаратов могут зависеть от функциональной тяжести заболевания. Максимальный ответ на ингаляционные лекарственные препараты при тяжелой бронхиальной обструкции может быть достигнут только при использовании высоких доз препаратов [Douglas et al., 1985]. Причиной такого физиологического ответа при тяжелой степени бронхиальной обструкции может быть наличие анатомических препятствий (секрет, спазм, отек слизистой и другие нарушения) для доступа препарата к рецепторам и, возможно, потребность большей пропорции доступных рецепторов для достижения максимального ответа.
2)предпочтение пациента, что выражается в том, что многие больные во время обострения заболевания предпочитают использовать терапию и технику, отличную от той, которую они используют в привычной, домашней среде.
4
3) практическое удобство. Несмотря на то, что эффективность ингаляционной техники при использовании ДИ со спейсером и небулайзера приблизительно одинаковы во многих ситуациях, использование небулайзеров является более простым методом терапии, не требует обучения пациента дыхательному маневру и контроля врача за техникой ингаляции. Небулайзер помогает быть уверенным, что больной получает правильную дозу лекарственного препарата.
Также следует напомнить другие достоинства небулайзера по сравнению с другими средствами доставки: в случае необходимости во время ингаляции возможно использование кислорода; при небулизации нет высвобождения фреона, т.е. использование небулайзеров отвечает требованиям экологической безопасности – сохранение озонового слоя атмосферы.
Доставка препарата в дыхательные пути зависит от множества факторов, важнейшим из которых является размер частиц лекарственного аэрозоля. Условно распределение частиц аэрозоля
вдыхательных путях в зависимости от их размера можно представить следующим образом:
-Более 10 мкм - осаждение в ротоглотке
- 5-10 мкм - осаждение в ротоглотке, гортани и трахее - 2-5 мкм - осаждение в нижних дыхательных путях - 0,5-2 мкм - осаждение в альвеолах
- менее 0,5 мкм - не осаждаются в легких [Barry & O’Callaghan, 1995].
Эффективность продукции аэрозоля, свойства аэрозоля и его доставка в дыхательные пути зависят от типа небулайзера, его конструкционных особенностей, сочетания системы компрессорнебулайзер и др.
Устройство и принцип действия
В зависимости от вида энергии, превращающей жидкость в аэрозоль, различают три основных типа небулайзеров: 1) струйныеиликомпрессорные,пневматические– использующие энергию струи газа (воздух или кислород); 2) ультразвуковые – использующие энергию колебаний пьезокристалла; 3) мембранные – использующие вибрирующую мембрану или пластину с множественными микроскопическими отверстиями.
Струйные небулайзеры
Струйный небулайзер представляет собой прибор, состоящий из емкости для жидкого лекарственного препарата (камеры), загубника или маски, тонких пластиковых трубочек и источника «рабочего» газа – компрессора (устройства, производящего поток воздуха) или стационарного источника кислорода или воздуха (в клиниках).
ПринципработыструйногонебулайзераоснованнаэффектеБернулли[Pedersen,1996].Воздухили кислород (рабочий газ) входит в камеру небулайзера через узкое отверстие (которое носит название Вентури). На выходе из этого отверстия давление падает, и скорость газа значительно возрастает, что приводит к засасыванию в эту область пониженного давления жидкости через узкие каналы из резервуара камеры [Muers, 1997; O’Callaghan, 1997]. При встрече жидкости с воздушным потоком, под действием газовой струи она разбивается на мелкие частицы, размеры которых варьируют от 15 до 500 µм – это так называемый «первичный» аэрозоль. В дальнейшем, эти частицы сталкиваются с «заслонкой», в результате чего образуется «вторичный» аэрозоль – ультрамелкие частицы размерами от 0,5 до 10 µм (около 0,5% от первичного аэрозоля), который далее ингалируется, а большая доля частиц первичного аэрозоля (около 99,5%) осаждается на внутренних стенках камеры небулайзера и вновь вовлекается в процесс образования аэрозоля (рис.1).
5

Рисунок 1. Устройство струйного небулайзера
Типы струйных небулайзеров
Различают три основных типа струйных небулайзеров [Knoch & Sommer, 2000].
-Конвекционные (обычные) небулайзеры с постоянным выходом аэрозоля
-Небулайзеры, активируемые вдохом (Вентури)
-Небулайзеры, синхронизованные с дыханием (дозиметрические)
Конвекционный (обычный) небулайзер является наиболее распространенным типом систем доставки. Такой небулайзер производит аэрозоль с постоянной скоростью, во время вдоха происходит вовлечение воздуха через Т-трубку и разведение аэрозоля. Аэрозоль поступает в дыхательные пути только во время вдоха, а во время выдоха аэрозоль выходит во внешнюю среду, т.е. происходит потеря его большей части (около 60-70%) [Jackson, 1998]. Такая «холостая» работа небулайзера значительно повышает стоимость терапии, и, кроме того, повышает риск экспозиции с лекарственным препаратом медицинского персонала.
Рисунок 2. Устройство небулайзера, активируемого вдохом
Небулайзеры, активируемые вдохом (известные также, как небулайзеры Вентури) также продуцируют аэрозоль постоянно на протяжении всего дыхательного цикла, однако высвобождение аэрозоляусиливаетсявовремявдоха.Такойэффектдостигаетсяпутемпоступлениядополнительного потока воздуха во время вдоха через специальный клапан в область продукции аэрозоля, общий поток увеличивается, что ведет и к увеличению образования аэрозоля. Во время выдоха клапан закрывается и выдох больного проходит по отдельному пути и минует область продукции аэрозоля (рис.2). Таким образом, соотношение выхода аэрозоля во время вдоха и выдоха увеличивается (рис.3), повышается количество вдыхаемого препарата, снижается потеря препарата, а время небулизации сокращается [O’Callaghan, 1997; Jackson, 1998]. Примером небулайзеров данного типа являются Pari LC Plus (Pari Gmbh, Germany) и Ventstream (Medic-Aid Ltd, UK).
Небулайзеры, синхронизованные с дыханием (дозиметрические небулайзеры) производят аэрозоль только во время фазы вдоха. Генерация аэрозоля во время вдоха обеспечивается при помощи электронных сенсоров потока либо давления, и, теоретически, соотношение выхода аэрозоля во время вдоха и выдоха достигает значения 100 : 0 (рис.3).
6 |
|
7 |
|
||
|
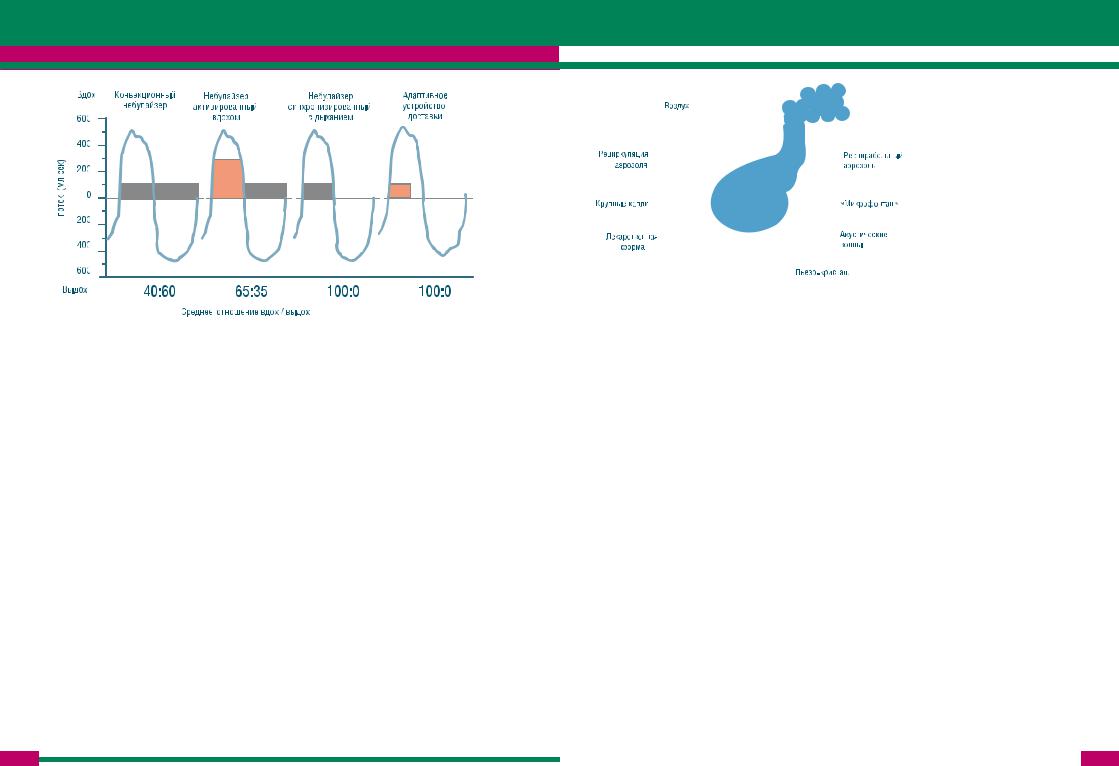
Рисунок 3. Доставка препаратов при использовании струйных небулайзеров различных типов
[Nikander, 1994; 1997].
Основным достоинством дозиметрического небулайзера является снижение потери препарата во время выдоха. Дозиметрические небулайзеры имеют неоспоримые достоинства при ингаляции дорогих препаратов, т.к. снижают их потерю до минимума. Адаптивные устройства доставки также относятся к типу дозиметрических небулайзеров, хотя некоторые специалисты считают их новым классом ингаляционных устройств [Nikander, 1997]. Их принципиальным отличием является адаптация продукции и высвобождение аэрозоля с дыхательным паттерном больного. Устройство автоматически анализирует инспираторное время и инспираторный поток больного (на протяжении трех дыхательных циклов), и затем на основе этого анализа аппарат обеспечивает продукцию и высвобождение аэрозоля в течение первых 50% последующего вдоха. Примерами небулайзера данного типа являются Halolite® (Medic-Aid Ltd, UK) и I-nebTM AAD® System (Respironics, US).
Ультразвуковые небулайзеры
Ультразвуковые(УЗ)небулайзерыдляпродукцииаэрозоляиспользуютэнергиювысокочастотных колебаний пьезокристалла. Сигнал высокой частоты (1-4 MHz) деформирует кристалл, и вибрация от кристалла передается на поверхность раствора препарата, где происходит формирование «стоячих» волн [Swarbrick, 1997]. При достаточной частоте ультразвукового сигнала на перекрестье этих волн происходит образование «микрофонтана» (гейзера), т.е. образование и высвобождение аэрозоля. Размер частиц обратно пропорционален акустической частоте сигнала 2/3 степени. Частицы большего диаметра высвобождаются на вершине гейзера, а меньшего – у его основания [Dessanges 1999]. Как и в струйном небулайзере, частицы аэрозоля сталкиваются с «заслонкой», более крупные возвращаются обратно в раствор, а более мелкие – ингалируются (рис.4).
8
Продукция аэрозоля в ультразвуковом небулайзере практически бесшумная, и более быстрая по сравнению со струйными [O’Callaghan & Barry
1997]. Однако, их недостатками являются неэффективность производства аэрозоля из суспензий и вязких растворов; как правило, больший оста-
точный объем; повышение
температуры лекарственного раствора во время небулизации и возможность разрушения структуры лекарственного препарата
[Nikander, 1994].
Однако, традиционные струйные и УЗ небулайзеры не лишены и недостатков: большой объем наполнения камеры небулайзера, длительное время ингаляции, относительно невысокая легочная депозиция препаратов и другие (табл.1).
Таблица 1. Преимущества и недостатки струйных и ультразвуковых небулайзеров.
Преимущества |
Недостатки |
|
|
Легкое использование во время спокойного дыхания |
Длительное время ингаляции |
Возможность использования при тяжелых |
Громоздкость оборудования |
заболеваниях |
Большие частицы первичного аэрозоля |
Возможность использования в любом возрасте |
Большой объем наполнения (не менее 2 мл) |
Визуальный контроль ингаляции пациентом (облачко |
Большой остаточный объем |
аэрозоля) |
Невысокая легочная депозиция |
Могут быть использованы разнообразные препараты |
Возможность контаминации аппаратуры |
и дозы препаратов |
|
|
|
Мембранные небулайзеры
Новоепоколениенебулайзеровимеетпринципиальноновоеустройствоработы–онииспользуют вибрирующую мембрану или пластину с множественными микроскопическими отверстиями (сито), через которую пропускается жидкая лекарственная субстанция, что приводит к генерации аэрозоля [Dhand, 2002]. Новое поколение небулайзеров имеет несколько названий: мембранные небулайзеры, электронные небулайзеры, небулайзеры с вибрирующим ситом (Vibrating Mesh Nebulizers – VMN).
В данных устройствах частицы первичного аэрозоля соответствуют размерам респирабельных частиц (чуть больше диаметра отверстий), поэтому не требуется использование заслонки. Данный тип технологии мембранных небулайзеров предполагает использование небольших объемов наполнения и достижение более высоких значений легочной депозиции по сравнению с обычными струйными или УЗ небулайзерами. Различают два типа мембранных небулайзеров – использующих «пассивную» и «активную» вибрацию мембраны [Vecellio, 2006].
9
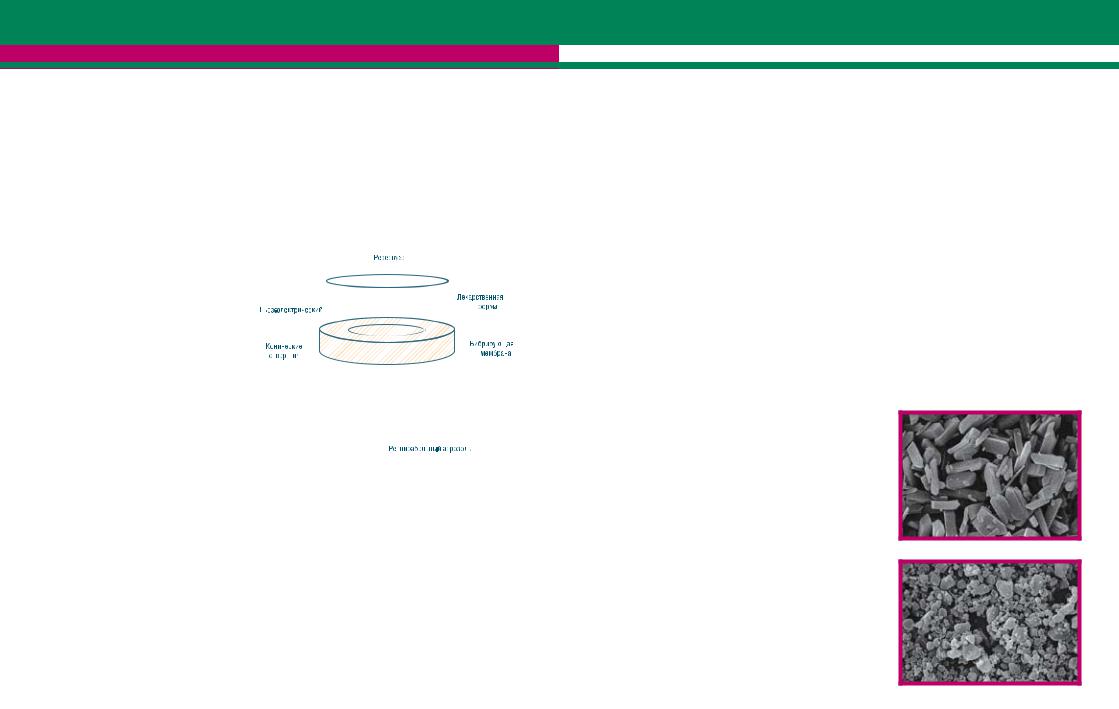
Внебулайзерах, использующих «активную» вибрацию мембраны, сама мембрана подвергается вибрации от пьезо-электрического кристалла. Поры в мембране имеют коническую форму, при этом самая широкая часть пор находится в контакте с лекарственным препаратом [Knoch, 2005].
Внебулайзерах данного типа деформация мембраны в сторону жидкого лекарственного вещества приводитк«насасыванию»жидкостивпорымембраны(рис.5).Деформациямембранывдругуюсторону приводит к выбрасыванию частиц аэрозоля в сторону дыхательных путей больного. Принцип «активной» вибрации мембраны используется в небулайзерах AeroNeb Pro и AeroNeb Go (Aerogen) и eFlow (Pari).
Вустройствах, в основе которых лежит «пассивная» вибрация мембраны, вибрации трансдьюсера (рожка) воздействуют на жидкое лекарственное вещество и проталкивают его через сито, которое колеблется с частотой рожка (рис.6) [Vecellio, 2006]. Данная технология была впервые представлена компанией Omron Healthcare в 1980 гг, однако в то время не получила широкого распространения [Newman, 2005]. В отличие от традиционных струйных или УЗ небулайзеров,
аэрозоль, который |
образуется |
|
|
|
||||
при |
прохождении |
жидкого |
|
|
|
|||
лекарственного вещества |
через |
|
|
|
|
|||
мембрану-сито, не подвергается |
|
|
|
|
||||
|
|
|
|
|||||
обратной |
рециркуляции |
и |
|
|
|
|||
может быть сразу доставлен в |
|
|
|
|||||
|
|
|
||||||
дыхательные |
пути |
больного. |
|
|
|
|||
Основные |
показатели |
функ- |
|
|
|
|||
ционирования |
мембранных |
небу- |
|
|
|
|||
лайзеров и их сравнение со струйным |
|
|
|
|||||
небулайзером |
представлены в |
|
|
|
||||
табл. 2 и 3. Следует отметить, что |
|
|
|
|||||
все известные на сегодня мемб- |
|
|
|
|||||
ранные небулайзеры соответсвуют |
|
|
|
|||||
всем |
Европейским |
стандартам |
|
|
|
|||
ингаляционной терапии [Vecellio,
2006]. В отличие от традиционных |
Рисунок 5. Устройство небулайзера с «активной» вибрацией мембраны. |
|
УЗ небулайзеров, в мембранных небулайзерах энергия колебаний пьезо-кристалла направлена не на раствор или суспензию, а на вибрирующий элемент, поэтому не происходит согревания и разрушения структуры лекарственного вещества. Благодаря этому, мембранные небулайзеры могут быть использованы при ингаляции протеинов, пептидов, инсулина и антибиотиков [Dhand, 2002].
Таблица 2. Характеристика мембранных небулайзеров.
Название |
Тип небулайзера |
Дезинфекция |
Срок службы |
Больные |
Максимальный |
||
|
|
|
|
|
|
объем наполнения |
|
MicroAir® NU22V |
Пассивная вибрация |
Р-рбензалкония(1%); |
3 |
года |
Спонтанное |
7 мл |
|
мембраны |
автоклавирование |
дыхание |
|||||
Aeroneb® Go |
Активная вибрация |
Нет рекомендаций |
1 |
год |
Спонтанное |
6 мл |
|
мембраны |
дыхание |
||||||
|
|
|
|
|
|||
Aeroneb® Pro |
Активная вибрация |
Автоклавирование |
1 |
год |
Дыхание во |
10 мл |
|
мембраны |
время ИВЛ |
||||||
|
|
|
|
|
|||
eFlow® rapid |
Активная вибрация |
Автоклавирование |
6 |
мес |
Спонтанное |
6 мл |
|
мембраны |
дыхание |
||||||
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
Таблица 3. Сравнение основных показателей мембранных небулайзеров и струйного небулайзера.
Название |
MMAD, µm |
Выход аэрозоля, |
Ингаляционная |
Остаточный |
Тип небулайзера |
|
|
|
мл/мин |
фракция, % |
объем, мл |
|
|
Omron MicroAir |
3.2- 4.8 |
0.2-0.3 |
35 |
0.3 |
Мембранный |
|
NE-U22 |
стандартный |
|||||
|
|
|
|
|||
Aeroneb® Go |
5.0 |
0.3-0.5 |
24 |
0.3-0.9 |
Мембранный |
|
стандартный |
||||||
Aeroneb® Pro |
3-5 |
0.3-0.5 |
? |
<0.3 |
Мембранный |
|
стандартный |
||||||
|
|
|
|
|
||
eFlow® rapid |
4.1 |
0.3-0.7 |
25 |
>1.2 |
Мембранный,акти- |
|
|
|
|
|
|
вируемый вдохом |
|
Pari LC Plus® |
4.4 |
0.2-0.3 |
23 |
>1.2 |
Струйный, активи- |
|
|
руемый вдохом |
|||||
|
|
|
|
|
К потенциальным недостаткам мембранных небулайзеров относится возможность засорения миниатюрных отверстий частицами аэрозоля, особенно при использовании суспензий [Dhand, 2002]. При блокаде пор небулайзер может оставаться способным к генерации аэрозоля, однако специфические характеристики аэрозоля могут быть значительно нарушены, что, в свою очередь, приводит к снижению эффективности ингаляционной терапии. Риск развития засорения отверстий зависит от частоты и условий обработки ингаляторов.
Благодаря более высокой эффективности мембранных небулайзеров, при их использовании требуется уменьшение стандартных доз и объема наполнения лекарственных препаратов [Newman et al., 2004].
Особенности использования Пульмикорта Суспензии для небулайзеров
Чаще всего в клинической практике для ингаляции при помощи небулайзеров используются лекарственные формы в виде растворов. Принцип генерации аэрозоля из суспензий, являющихся основой Пульмикорта Суспензии, имеет значительные отличия. Суспензия состоит из нерастворимых твердых частичек, взвешенных в жидкой среде (воде). При небулизации суспензии препарата каждая частичка аэрозоля является потенциальным носителем для твердой частицы, поэтому при ингаляции суспензий очень важно, чтобы размер частиц суспензированного препарата не превышал размер частиц раствора (т.е. 3-5 мкм). Средний диаметр частиц суспензии Пульмикорта составляет 2.2-2.9 мкм [Jackson, 1998]. Таким образом, частицы суспензии Пульмикорта имеют оптимальные размеры для ингаляций, что и объясняет их преимущество по сравнению с использовавшейся ранее суспензией бекламетазона дипропионата, частицы которой имели вытянутую форму, с длиной, часто превышавшей 10
мкм (рис.7) [Jackson, 1998].
Для эффективной ингаляции Пульмикорта рекомендовано использовать только определенные типы небулайзеров. При сравнении продукции аэрозоля будесонида при использовании трех разных небулайзеров
10 µm
Пульмикорт®
10 µm
Беклометазона дипропионат
Рисунок 7. Электронная микроскопия частиц суспензий кортикостероидов.
10 |
|
11 |
|
||
|

в исследовании in vitro было установлено, что небулайзер Pari LC Plus при всех изученных диапазонах дыхательного объема (50, 150 и 600 мл) превосходил небулайзеры Ventstream и Cirrus по параметру выхода аэрозоля (р< 0.01) [Barry & O’Callaghan, 1998]. В рандомизированном контролируемом исследовании Dahlstrom и Larsson сравнивали in vivo эффективность различных небулайзеров для ингаляции будесонида у 12 здоровых добровольцев. Оказалось, что максимальная депозиция препарата достигалась при использовании небулайзеров Pari LC Plus и Maxin MA-2, и составляла, в
среднем, 15-16% [Dahlstrom et al., 2003].
Для ингаляции будесонида рекомендовано использовать определенные сочетания небулайзеркомпрессор (табл.4) [Smaldone et al., 1998]. Ультразвуковой небулайзер является малоэффективной системой доставки лекарственных суспензий. В исследовании Nikander и кол. было установлено, что доставленная доза будесонида приблизительно в три раза ниже при использовании ультразвукового небулайзера по сравнению со струйным, поэтому ультразвуковые небулайзеры не рекомендуются для ингаляции Пульмикорта [Nikander,1999].
Вто же время мембранные небулайзеры могут быть использованы и для небулизации суспензий.
Висследовании in vitro Yoshiyama и кол. показали, что Omron MicroAir NE-U22 способен эффективно производить аэрозоль из суспензии будесонида, при этом в аэрозоль попало около 70% от дозы будесонида [Yoshiyama et al., 2002].
Таблица 4. Исследование in vitro доставки будесонида по помощи систем небулайзер-компрессор.
Небулайзер |
Компрессор |
Доставка аэрозоля % (SD) |
|
|
|
Pari LC Plus |
Pulmo-Aide |
17.8 + 1.0 |
Pari LC Plus |
Pari Master |
16.6 + 0.4 |
Intertech |
Pulmo-Aide |
14.8 + 2.1 |
Baxter Misty-Neb |
Pulmo-Aide |
14.6 + 0.9 |
Hudson T-Updraft II |
Pulmo-Aide |
14.6 + 1.2 |
Pari LC |
Pulmo-Aide |
12.5 + 1.1 |
DeVilbiss Pulmo-Neb |
Pulmo-Aide Traveller |
11.8 + 2.0 |
DeVilbiss Pulmo-Neb |
Pulmo-Aide |
9.3 + 1.4 |
|
|
|
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА БУДЕСОНИДА
Будесонид относится к негалогенизированым кортикостероидам и обладает высокой ГКСактивностью и слабой минералокортикоидной активностью. Будесонид является рацемической смесью, в соотношении 1 : 1, двух эпимеров, 22R и 22S. Оба эпимера обладают высокой ГКСактивностью, однако аффинность к рецепторам эпимера 22R в 2 раза выше по сравнению с эпи-
мером 22S [Szefler, 1999].
Будесонид, как и другие иГКС, является высоко липофильным соединением, он быстро проникает в клетки-мишени, где связывается с цитозольными ГКС-рецепторами. Комплексы стероидрецептор быстро транспортируются к ядру, где они связываются ГКС-специфичными элементами гена, таким образом усиливая либо уменьшая транскрипцию генов. ГКС-рецепторы могут также взаимодействовать с факторами транскрипции протеинов в цитоплазме, и, вследствие этого, влиять на синтез некоторых протеинов независимо от взаимодействия с ДНК в ядре клетки [Barnes, 1997]. Прямое подавление транскрипторных факторов, таких как АР-1 и NF-kB, возможно, связано со многими противовоспалительными эффектами ИКС. По сравнению с натуральным лигандом кортизолом, будесонид обладает приблизительно в 200 раз большей афинностью к ГКС-рецепторам и в 1000 раз большей локальной противовоспалительной активностью [Szefler, 1999].
12
В лабораторных и клинических исследованиях показано высокое соотношение местной активности будесонида и его системной активности, что объясняется почти полным метаболизмом абсорбированного препарата при первом прохождении через печень (85-95%) и низкой активностью метаболитов будесонида [Brogden & McTavish, 1992]. По своей противовоспалительной активности будесонид превосходит преднизолон в 58 раз [Toogood et al, 1989].
Будесонид, как и другие иГКС, обладает прямыми ингибиторными эффектами на многие клетки, вовлеченные в воспалительный процесс дыхательных путей, включая макрофаги, Т-лимфоциты, эозинофилы, тучные клетки, эпителиальные клетки [Schleimer,1990). ГКС предотвращают и снижают сосудистую проницаемость вследствие действия воспалительных медиаторов и ведут к разрешению отека дыхательных путей. ГКС также обладают прямым ингибиторным эффектом на секрециюгликопротеиновслизиизподслизистыхжелездыхательныхпутей,чтоведеткуменьшению образования бронхиального секрета. ИГКС повышают чувствительность адрено-рецепторов клетокмишеней к ß2-агонистам и предотвращают, либо ведут к обратному развитию субсенситизации к этим препаратам [Barnes, 1997].
В отличие от других иГКС, будесонид обладает его уникальной способностью обратимо связываться внутри клетки с жирными кислотами [Edsbacker,1999]. Конъюгированный будесонид не связывается с рецепторами, однако остается внутри клетки. Со временем, под действием внутриклеточных липаз, будесонид медленно высвобождается и вновь обретает способность к взаимодействию с рецепторами, таким образом обеспечивая продолженный противовоспалительный эффект будесонида (рис.8) [Miller-Larsson et al, 2000].
Биодоступность оральной фракции будесонида у взрослых колеблется от 6% до 11% [Hvizdos & Jarvis, 2000].
Элиминация препарата зависит от печеночного кровотока, что типично
для |
субстанций, |
подвергающихся |
почти |
полному |
метаболизму (85- |
95%) при первом прохождении через печень. Действительно, будесонид быстро и практически полностью метаболизируется в печени цитохромом P450 3A4, полупериод элиминации составляет от 1.5 до
3часов. Основные метаболиты
будесонида – 6ß-гидроксибудесонид и |
|
|||
16ß-гидроксипреднизолон – обладают |
|
|||
крайне |
низкой |
кортикостероидной |
|
|
активностью (< 1%). Основная часть |
|
|||
(70%) оральной и легочной фракций |
|
|||
будесонида элиминируются через почки, |
|
|||
при этом |
пропорция неизмененного |
|
||
препарата в моче ничтожна. |
|
|
||
Фармакокинетические |
свойства |
|
||
небулизированного |
будесонида предс- |
|
||
Рисунок 8. Связывание будесонида с жирными кислотами внутри клетки-мишени |
||||
тавлены в табл.5 [Szefler, 1999]. |
|
[Miller-Larson A et al., 1997]. |
||
13
Таблица 5. Фармакокинетика небулизированного будесонида
Параметр |
|
Значение |
|
|
|
Общая системная биодоступность (легочная и оральная) |
6 % |
|
Время достижения пиковой концентрации в плазме |
10-30 минут |
|
Пиковая концентрация в плазме |
2.6 |
нмоль/л |
AUC на мг номинальной дозы |
4.6 |
нмоль/л х час/мг |
Объем распределения в стабильном состоянии |
3 л/кг |
|
Общий системный клиренс |
0.5 |
л/мин |
Период полужизни в плазме |
2.3 |
часа |
AUCплощадь под концентрационной кривой
НЕБУЛИЗИРОВАННЫЙ ПУЛЬМИКОРТ ПРИ СТАБИЛЬНОМ ТЕЧЕНИИ БРОНХИАЛЬНОЙ АСТМЫ И ХОБЛ
Небулизированный Пульмикорт у пожилых больных с БА и ХОБЛ
Несмотря на то, что небулайзерная терапия иГКС может использоваться в любом возрасте, у пожилых больных, не способных правильно использовать другие устройства доставки аэрозоля, она может иметь особое значение. Marcus и кол. на основе базы данных больных PharMetrics Database (США) изучили влияние небулайзерной терапии суспензией будесонида на использование ресурсов здравоохранения у пожилых больных [Marcus et al., 2006]. Были проанализированы данные больных старше 50 лет, пользующихся небулайзерной терапией Пульмикортом более 1 года (в 1999-2003 гг), и проведено сравнение числа госпитализаций и обращений за медицинской помощью больных в течение 6 мес. до начала ингаляционной терапии иГКС и в течение 6 мес. после начала использования небулайзерной терапии.
Из общего числа 2178 больных, пользующихся небулайзерной терапией будесонидом, для анализа были отобраны данные 668 больных, из которых 57.4% больных имели диагноз «бронхиальная астма» (БА) и 52.1% больных – диагноз «хроническая обструктивная болезнь легких» (ХОБЛ). Небулайзерная терапия была назначена больным либо врачами общей практики либо пульмонологами. Более 40% больных использовали небулайзерную терапию Пульмикортом ежедневно (как минимум, одна ампула в сутки), и общее число дней использования ингаляционной терапии составляло 123.4 дня на протяжении 6 мес. наблюдения.
Назначение небулайзерной терапии Пульмикортом пожилым больным привело к уменьшению числа курсов терапии системными ГКС (48.0% vs 38.8%; отношение шансов (ОШ) 0.7; 95% доверительный интервал (ДИ) 0.5–1.0; р=0.03). Кроме того, сократилось число визитов больных в отделение неотложной терапии: 20.2% и 15.0% больных до и после начала ингаляционной терапии, соответственно (ОШ 0.7; 95%ДИ 0.45–1.09; р=0.12); а также уменьшилось число госпитализаций больных в стационар: 20.5% и 17.5% больных до и после начала ингаляционной терапии (ОШ 0.8; 95%ДИ 0.54–1.27; р=0.38) (рис.9). Использование небулайзерной терапии не сопровождалось повышением общей стоимости терапии больных.
14
Таким образом, данное ретроспективное исследование продемонстрировало, что у пожилых больных с БА и ХОБЛ небулайзерная терапия Пульмикортом приводит к уменьшению использования ресурсов здравоохранения, т.е. снижению числа госпитализаций и обращений больных за медицинской помощью, и при этом, не повышает общую стоимость лечения.
Рисунок 9. Снижение использования ресурсов здравоохранения после начала терапии небулизированным будесонидом у пожилых больных с хроническими обструктивными заболеваниями легких [Marcus et al., 2006]. Примечание: ОНТ – отделение неотложной терапии.
Небулизированный Пульмикорт при стероидо-зависимой астме
В настоящее время доказано, что в патогенезе бронхиальной астмы основное место принадлежит процессу воспаления слизистых бронхов, и БА рассматривается как хроническое воспалительное заболевание дыхательных путей [GINA, 2006]. Глюкокортикостероиды являются наиболее эффективными противовоспалительными препаратами, используемыми в терапии БА. Основное место при длительном лечении БА играют иГКС, которые, по сравнению с системными стероидами, имеют более безопасный клинический профиль, т.е. при сравнимой высокой клинической эффективности сопровождаются значительно меньшим числом побочных эффектов. По мнению ведущих экспертов, внедрение иГКС в клиническую практику является революционным событием в терапииБА[Barnes,1998]и,согласнонациональнымимеждународнымСогласительнымдокументам, иГКС являются препаратами первой линии при всех формах хронической персистирующей БА [GINA, 2006].
Во всех возрастных группах больных БА есть пациенты, плохо отвечающие на обычную терапию иГКС. Причиной этому может быть:
-плохой комплаенс к ингаляционной терапии
-недостаточная доза иГКС
-неудовлетворительная ингаляционная техника
-стероидорезистентность (у небольшой группы больных).
Несмотря на то, что системные ГКС являются высоко эффективными потивовоспалительными препаратами, риск развития тяжелых, инвалидизирующих осложнений очень высок, поэтому всегда надо стремиться к переходу от системных к ингаляционным формам ГКС.
15
В данной ситуации замена ингаляционного устройства на небулайзер позволяет разрешить потенциально корригируемые проблемы, связанные с терапией иГКС (повышение дозы иГКС, улучшение ингаляционной техники, и, возможно, комплаенса к терапии), что, в свою очередь, позволяет либо прекратить, либо уменьшить дозу системных стероидов.
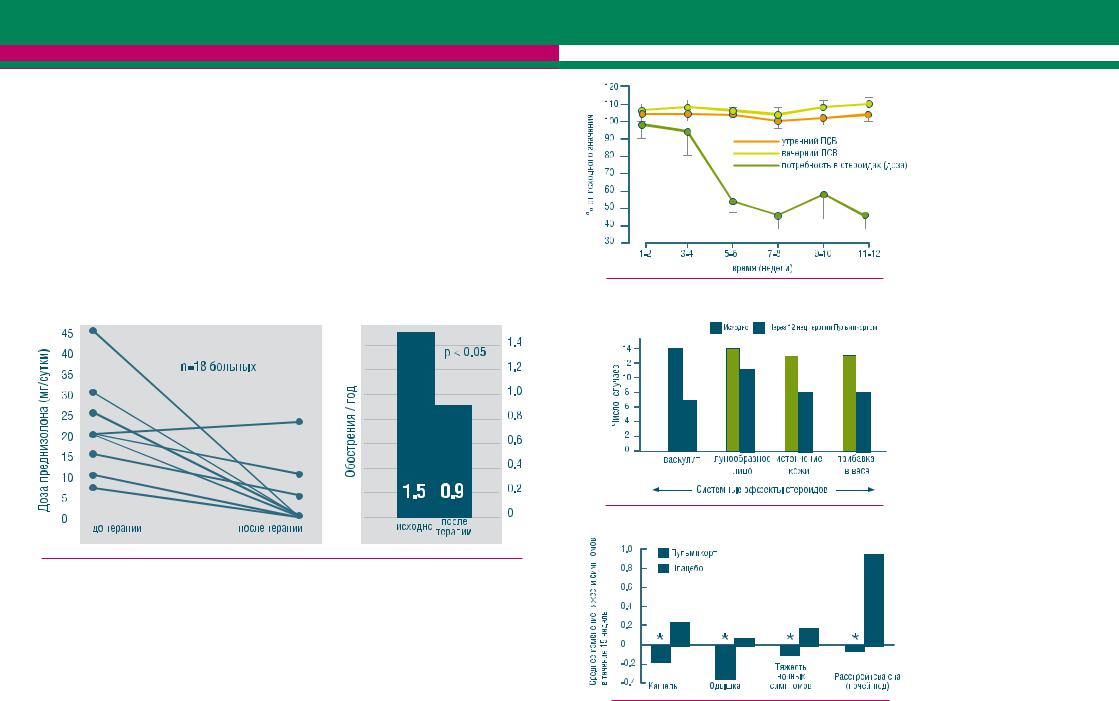
Одно из первых открытых исследований, посвященных изучению эффективности будесонида, доставляемого в дыхательные пути с помощью небулайзера, у взрослых больных БА провели Otulana и кол. [Otulana et al., 1992]. В исследование было включено 18 больных (возраст 9-62 года) со стероидо-зависимой БА, нуждавшихся в приеме суточной дозы преднизолона более 7.5 мг на протяжении не менее 2-х лет и также принимавших ингаляционные ГКС в виде дозированных ингаляторов: беклометазон 1200 мкг/с или будесонид 1600 мкг/с. Всем больным в течение 12-18 месяцев назначали небулизированный Пульмикорт в дозе 4-8 мг/с, в результате чего 14 больных полностью прекратили прием стероидов per os, и 3 больных уменьшили дозу системных ГКС до 1/3-1/2 от первоначальной дозы. Все пациенты отметили субъективное улучшение клинических симптомов, достоверно повысились показатели пиковой скорости выдоха (ПСВ): от 238 ± 119 л/мин до 286 ±130 л/мин (р < 0.05) и значительно снизилась частота госпитализации в стационар: от 1.5± 1.8 раз/год до 0.9 1.1раз/год (р=0.05) (рис.10).
Рисунок 10. Небулизированный будесонид у больных со стероидо-зависимой бронхиальной астмой: снижение дозы системных стероидов и уменьшение числа обострений [Ottulana et al., 1992].
Стероидосберегающий эффект небулизованного Пульмикорта был подтвержден в мультицентровом исследовании Higgenbottam и кол., включавшем 42 больных (возраст 18-73 лет) со стероидо-зависимой БА, принимавших системные ГКС в дозах 5-40.4 мг (в перерасчете на преднизолон) в течение, в среднем, 4.2 лет, а также высокие дозы ингаляционных стероидов при помощи дозированных ингаляторов и спейсера (дозы более 2 мг/с) [Higgenbottam et al., 1994]. После 12 недель терапии Пульмикортом в дозе 2 мг/с через небулайзер 23 больных снизили дозу пероральных ГКС, в среднем, на 59% от исходной дозы 12.3 ± 1.5 мг/сутки (р< 0.0001). В то же время функциональные показатели не изменились, или даже улучшились: повышение утреннего показателя ПСВ, в среднем, на 6% (р< 0.05) (рис.11).
Рисунок 11. Небулизированный Пульмикорт® у больных со стероидо-зависимой бронхиальной астмой [Higenbottam et al., 1994].
Рисунок 12. Побочные эффекты терапии ГКС до и после 12-недельного курса терапии Пульмикортом® [Higenbottam et al., 1994].
Рисунок 13. Пульмикорт® улучшает симптомы у взрослых больных бронхиальной астмой [Connolly et al., 2000].
Сопутствующий прием ß2-агонистов не увеличился, субъективное улучшение симптомов отметили 80% всех больных, число побочных эффектов, связанных с приемом стероидов, также значительно уменьшилось, вплоть до полного исчезновения стероидных осложнений у 9 больных (рис.12). Таким образом, данное исследование доказывает, что ингаляционная терапия Пульмикортом с помощью небулайзера позволяет снизить дозу системных ГКС более чем у половины больных со стероидо-зависимой БА.
В рандомизированное двойное слепое исследование Conolly и кол. было включено 76 больных с тяжелой стероидозависимой БА, принимавших более5мгпреднизолонавсутки. В течение 15-и недель больные
одной группы в |
дополнение |
к преднизолону |
принимали |
небулизированный |
Пульмикорт |
2мгх2р/с(n=38),адругаягруппа
– плацебо (n=36). У больных, принимавших ингаляционный Пульмикорт, было отмечено более чем в раза снижение числа обострений БА (р<0.05), кроме того, у этих же больных наблюдалось значительное улучшение клинических симптомов (кашель, одышка, ночные симптомы и ночные расстройства сна) (рис.13) [Conolly et al., 2000].
16 |
|
17 |
|
||
|
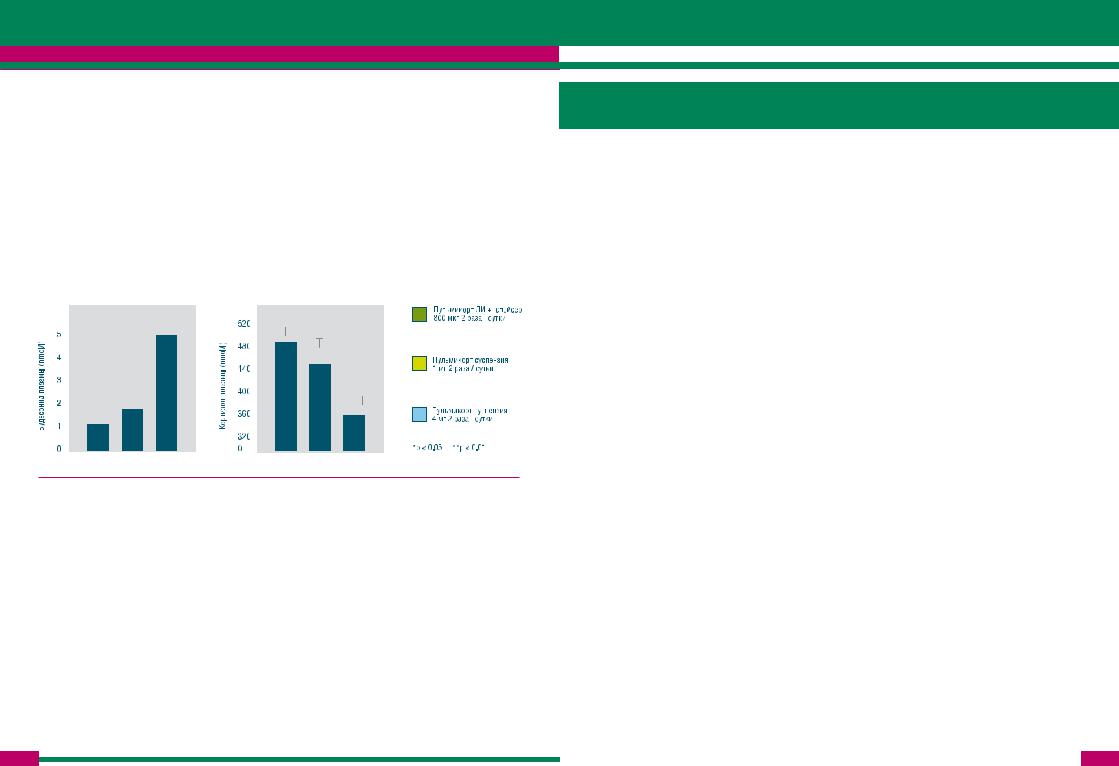
Пока нет ответа на важный вопрос: является ли эффект приема стероидов при помощи небулайзера следствием преимущества ингаляционной техники или просто отражением повышения дозы ГКС? Получены данные, согласно которым хорошая эффективность ГКС при использовании небулайзеров может быть просто связана с более высокой дозой препарата. В рандомизированном контролируемом перекрестном исследовании Bisgaard и кол. у 26 больных с тяжелой БА наблюдался дозо-зависимыйэффектингаляционногоПульмикортанасимптомызаболевания,уровенькортизола плазмы и уровень будесонида плазмы, причем различие эффектов было связано только с дозой Пульмикорта (8 мг/с через небулайзер > 2 мг/с через небулайзер > 1.6 мг/с через дозированный ингалятор и спейсер), но не с типом устройства доставки (рис.14) [Bisgaard et al., 1998].
В любом случае, существует группа больных с тяжелой хронической БА, которые способны правильно использовать лишь один вид доставки аэрозоля – небулайзер. Таким образом, у больных со стероидо-зависимой БА, имеющих сложности с переходом от пероральных на ингаляционные ГКС, терапия Пульмикортом с помощью небулайзера позволяет снизить общую дозу системных ГКС и значительно уменьшить побочные эффекты стероидной терапии.
Рисунок 14. Сравнение эффективности способов доставки будесонида при помощи небулайзера и дозированного ингалятора / спейсера [Bisgaard et al., 1998]. Примечание: ДИдозированный ингалятор
Небулизированный Пульмикорт при неконтролируемой бронхиальной астме
Относительно недавно Gawchik и кол. было представлено наблюдение за больными с тяжелой неконтролируемой БА, у которых улучшение течения заболевания было достигнуто только при использовании небулизированного Пульмикорта [Gawchik, 2007]. До назначения небулайзерной терапии все больные получали высокие дозы иГКС при помощи ДАИ.
Наблюдение за больными продолжалось около 5 лет. Терапия Пульмикортом в дозе 1 мг 2 раза в сутки привела к улучшению показателей ПСВ, уменьшению числа визитов к врачу и курсов системных ГКС, т.е., в целом, к улучшению контроля БА. Впоследствии у большинства больных БА удалось уменьшить дозу Пульмикорта до 0.5 мг 2 раза в сутки, а у одного больного – до 0.5 мг 1 раз в сутки. Причинами большей эффективности небулайзерной терапии Пульмикортом, по сравнению с предшествующей терапией иГКС с помощью ДАИ, оказались: плохая ингаляционная техника и низкий комплайенс к терапии при использовании ДАИ и предпочтение больными небулайзера как средства доставки ингаляционных препаратов. Таким образом, у ряда больных небулайзерная терапия Пульмикортом позволяет добиться лучшего контроля БА.
18
НЕБУЛИЗИРОВАННЫЙ ПУЛЬМИКОРТ ПРИ ОБОСТРЕНИЯХ БРОНХИАЛЬНОЙ АСТМЫ И ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНИ ЛЕГКИХ
Роль ГКС при обострениях бронхиальной астмы и ХОБЛ
Системные ГКС рассматриваются как препараты первой линии терапии обострений БА [GINA, 2006]. Многочисленные рандомизированные контролируемые исследования (РКИ) показали, что использованиесистемныхГКСубольныхсобострениемБА,втомчисле,истяжелымобострениемБА, приводит к более быстрому разрешению бронхиальной обструкции [Rowe et al, 1992] и значительно снижает риск рецидивов обострения БА после выписки из стационара [Rowe et al, 1999].
Традиционными компонентами терапии обострения ХОБЛ являются бронхолитики, антибиотики и кислородотерапия [GOLD, 2006]. В нескольких рандомизированных контролируемых исследованиях, проведенных в течение последнего десятилетия, получены доказательства о положительной роли ГКС при обострении ХОБЛ: показана способность системных ГКС улучшать функциональные показатели (объем форсированного выдоха за 1 сек – ОФВ1) и параметры оксигенации (PaO2), снижать риск «неудач» терапии и сокращать длительность пребывания больных в стационаре [Davies et al., 1999; Niewoehner et al., 1999; GOLD, 2006].
Однако, к сожалению, многочисленные исследования, посвященные эффективности системных ГКС при обострениях БА и ХОБЛ, очень редко обращали внимание на развитие побочных эффектов при применении этого вида терапии. Даже короткие, но частые курсы терапии системными ГКС у больных с БА и ХОБЛ могут приводить к развитию тяжелых нежелательных реакций [Shee, 1990; Niewoehner et al., 1999; Matsumoto et al., 2001]. Кроме того, системные стероиды имеют относительно медленное начало действия – их эффект наступает не ранее, чем через 6-24 часа от начала терапии
[Rodrigo & Rodrigo, 1999].
Вкачестве альтернативы системным ГКС рассматриваются ингаляционные ГКС (иГКС), их преимуществом является гораздо меньший риск развития побочных эффектов [Pedersen, 1997]. В то же время получены данные о более быстром действии ГКС при их ингаляционном назначении (в
течение 1-3 часов) [Rodrigo & Rodrigo, 1998; Rodrigo, 2006; Belda et al., 2007].
Всовременной редакции руководства GINA 2006 г. иГКС рассматриваются как «эффективные препараты для терапии обострений БА» (уровень доказательства В) [GINA, 2006].
Более высокая безопасность иГКС по сравнению с системными ГКС
Серьезными недостатками системных ГКС является их высокий потенциал развития побочных эффектов. Использование стандартных доз системных ГКС у больных с БА может приводить к развитию тяжелых миопатий и остеопороза [Shee, 1990; Packe et al. 1992; Matsumoto et al., 2001].
У больных с обострениями ХОБЛ и БА достаточно хорошо документированы серьезные побочные реакции системных ГКС во время непродолжительных курсов терапии: подавление функции надпочечников [Dolan et al., 1987; Henzen, 2000]; снижение минеральной плотности костей и переломы позвонков [McEvoy, 1998]; острые язвы желудка [Messer, 1983]; острые психозы [Boston et al., 1972], миопатии периферических и дыхательных мышц [Shee, 1990; Decramer, 1994; Nava, 2002]; инфекционные осложнения, в том числе и такие фатальные, как инвазивный легочный аспергиллез [Bulpa, 2001; Bulpa, 2007]. По данным крупного ретроспективного исследования, у больных отделений интенсивной терапии системные ГКС повышают риск легочных инфекций и метаболических осложнений [Rady et al., 2006].
19
