
- •Строение вещества
- •Методические указания для самостоятельной работы
- •Студентов всех специальностей и проведения
- •Практических занятий по химии
- •1 Строение атома
- •1.1 Современные представления о строении атома
- •1.2 Строение электронной оболочки атома
- •1.2.2 Принципы заполнения атомных орбиталей.
- •1.3 Электронные формулы элементов
- •1.4 Электронные семейства элементов
- •1.5 Атомная валентная зона. Возможные валентные состояния
- •1.6 Проскок (провал) электронов
- •2 Периодическая система элементов
- •2.1 Периодический закон
- •2.2 Современная структура Периодической таблицы Менделеева
- •2.3 Периодичность атомных характеристик
- •3 Химическая связь
- •3.1 Основные характеристики химической связи
- •3.3 Типы химических связей
- •3.4 Геометрия молекул. Гибридизация атомных орбиталей
- •3.5 Химическая связь в твердых телах. Кристаллические решетки
- •4 Вопросы и задания
1.6 Проскок (провал) электронов
Проскок электрона - отступления от общей для большинства элементов последовательности заполнения электронных оболочек (1s, 2s, 2p, 3s, 3p, 4s, 3d и так далее), связанные с тем, что эти "нарушения правил" обеспечивают атомам некоторых элементов меньшую энергию по сравнению с заполнением электронных оболочек "по правилам".
Объясняется это тем, что энергетически более выгодно, когда в атоме имеется наполовину или полностью заполненный подуровень (р3; р6; d5; d10; f7; f14). Поэтому в атомах элементов, у которых строение электронной оболочки близко к вышеуказанному, может наблюдаться преждевременное заполнение d- подуровня за счёт проскока (или провала) электрона с внешнего s- подуровня на нижележащий (предвнешний) d- подуровень (закономерные проскоки).
Таблица 4 – АВЗ элементов, характеризующихся провалом электрона
|
Элемент |
Атомная валентная зона | |
|
теоретическая |
практическая | |
|
Cu |
3d9 4s2 |
3d10 4s1 |
|
Ag |
4d9 5s2 |
4d10 5s1 |
|
Au |
5d9 6s2 |
5d10 6s1 |
|
Cr |
3d4 4s2 |
3d5 4s1 |
|
Mo |
4d45s2 |
4d5 5s1 |
Теперь для этих элементов определим возможные валентные состояния.
Построим энергетическую диаграмму АВЗ для меди.

На этой диаграмме изображение s– электронов имеет чуть больший размер, чем d– электронов.
В таком состоянии медь одновалентна, так как присутствует только один неспаренный электрон. А на практике оказывается, что медь проявляет валентность, равную двум. Следовательно, возможно, вопреки правилу, перевести один проскочивший электрон с предвнешнего 3d– подуровня на внешний 4р– подуровень. В этом случае В*=2.
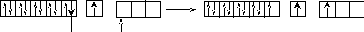
Поскольку остаётся ещё один неспаренный электрон на предвнешнем d– подуровне, то медь может быть, хотя и реже (так как этот электрон менее активен), трехвалентна.
Остальные 3d– электроны перевести на р– подуровень нельзя, поскольку это другой энергетический уровень.
Для золота характерна та же картина: В = 1; 2*; 3*. Отличие заключается в том, что этот элемент стоит в шестом периоде и, следовательно, имеет больший радиус. Поскольку электроны ядром удерживаются слабее, то их оторвать проще. Поэтому золото чаще всего трёхвалентно, так как отдаёт сразу все электроны.
Серебро же, хотя и имеет сходную структуру АВЗ, проявляет единственную валентность, равную единице. Объясняется это строением электронной оболочки палладия- элемента, который стоит перед серебром. Дело в том, что палладий - единственный элемент в таблице, у которого происходит провал не одного электрона, а сразу двух. То есть, электронная формула имеет вид 4d10 5s0, вместо 4d8 5s2. Поэтому номер периода не соответствует количеству уровней, так как нет электронов – нет уровня. Серебро идёт сразу за палладием и у него происходит стабилизация 4d– подуровня (электрон оттуда вернуться уже не может), а следующий электрон попадает уже на 5s– подуровень.
Ч то
касается хрома и молибдена, то они имеют
абсолютно одинаковое строение АВЗ и
проявляют одинаковую валентность.
Энергетическая диаграмма:
то
касается хрома и молибдена, то они имеют
абсолютно одинаковое строение АВЗ и
проявляют одинаковую валентность.
Энергетическая диаграмма:
В данном случае s– электроны выделены более чётко, так как являются более активными. Поэтому при вступлении в связь хром и молибден отдают, как правило, не один, а сразу два электрона. Значит В*=2-6.
Можно привести достаточно большое количество незакономерных проскоков. Например, Ru : 4d75s1 (вместо 4d65s2), Pt: 5d96s1 (вместо 5d86s2) и так далее. Валентность рутения определяется по такому же принципу как и у хрома, а валентность платины – по такому же принципу как и у меди.
