
- •Химическая кинетика
- •Основные понятия химической кинетики
- •Факторы, влияющие на скорость химических реакций.
- •Примеры
- •Закон действующих масс (к. Гульдберг, п.Вааге, 1867г.)
- •Решение:
- •Примеры решения задач:
- •Задачи с использованием закона действия масс
- •Решение
- •Решение
- •Решение
- •Задачи с использованием закона Вант-Гоффа
- •Задачи с использованием закона объёмных отношений
- •Способы смещения равновесия
- •Примеры решения задач:
Задачи с использованием закона Вант-Гоффа
Пример 1
Как изменится скорость гомогенной реакции при повышении температуры от 670 до 970 при температурном коэффициенте равном четырём?
Решение
Запишем формулу закона Вант-Гоффа:
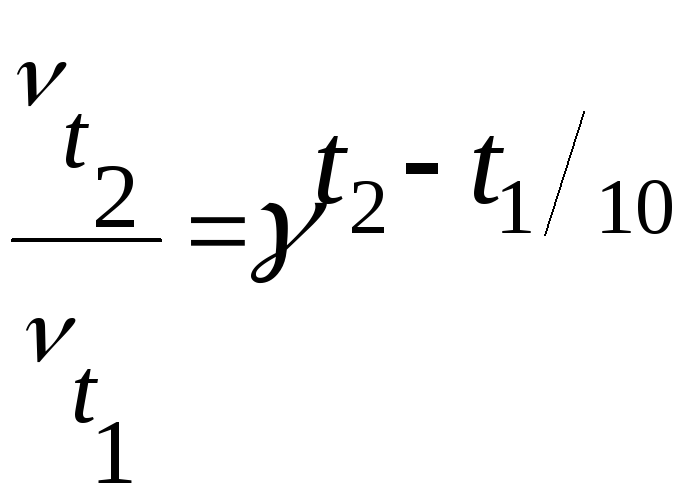
Подставим
известные данные:
 =430/10
=43
= 64,
где t2-конечная
температура (970),
а t1-начальная
температура (670).
Следовательно при
повышении температуры от 670
до 970
скорость гомогенной реакции увеличится
в 64 раза.
=430/10
=43
= 64,
где t2-конечная
температура (970),
а t1-начальная
температура (670).
Следовательно при
повышении температуры от 670
до 970
скорость гомогенной реакции увеличится
в 64 раза.
Пример 1
Рассчитайте чему равен температурный коэффициент скорости, если известно, что понижении температуры от 1500 до 1200 скорость реакции уменьшилась в 27 раз.
Решение
Запишем формулу закона Вант-Гоффа:

и
выразим из неё
![]() :
:
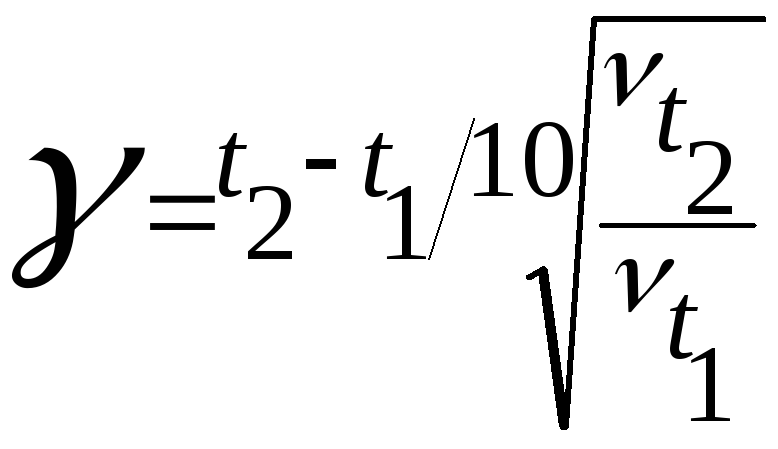 Подставим
данные
Подставим
данные
![]() =
=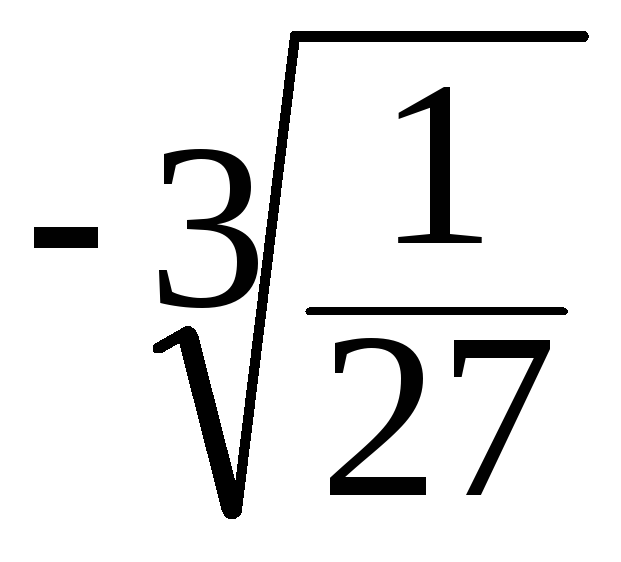 =3
=3
где
t2=120,
t1=150
(температура понижается ), а
![]() отношение конечной скорости к начальной,
т. к. при уменьшении температуры скорость
уменьшается.
отношение конечной скорости к начальной,
т. к. при уменьшении температуры скорость
уменьшается.
Задачи с использованием закона объёмных отношений
Формулировка закона: если в реакцию вступают газообразные вещества и такие же вещества образуются в результате реакции, то их обёмы относятся друг к другу как небольшие целые числа, равные стехиометрическим коэффициентам в уравнении реакции перед формулами этих веществ. Например, для гомогенной реакции aA + bB = cC + dD формула будет выглядеть следующим образом:
![]() ,
,
Этот закон относится к основным законам химии и может быть применён в химической кинетике применительно к концентрации.
Пример 1
Реакция идет по уравнению 2Н2(г)+O2(г)=2Н2O(г). Концентрации исходных веществ до начала реакции были [Н2]=0,06 моль/л, [O2]=0,02 моль/л. вычислите концентрации этих веществ в момент, когда [Н2O]=0,01 моль/л.
Решение:
В этой реакции Н2(г) и O2(г) относятся к исходным веществам, концентрация которых с течением времени уменьшается по мере того, как эти вещества расходуются, а Н2O(г) – к продуктам реакции, концентрация которых с течением времени увеличивается по мере того, как эти вещества образуются. Из закона объёмных отношений следует, что один объём О2 взаимодействует с двумя объёмами Н2 и при этом образуется два объёма Н2O, т. е. если получается 0,01 моль/л Н2O, то расходуется столько же Н2 и в два раза меньше О2. В виде формулы это можно записать следующим образом:
![]() :
отсюда x=0,01
моль/л
:
отсюда x=0,01
моль/л
где обр-образованное и изр-израсходованное
![]() :
отсюда x=0,005
моль/л
:
отсюда x=0,005
моль/л
Таким образом концентрации этих веществ в момент, когда [Н2O]=0,01 моль/л будет равна: [H2]=[H2]нач-[H2]изр=0,06-0,01=0,05моль/л и [O2]=[O2]нач-[O2]изр=0,02-0,005=0,015 моль/л (где нач- начальная концентрация веществ)
Пример 2
До начала реакции концентрации исходных веществ в гомогенной системе K+2L=3M+F
были равны: [K]=0,5 моль/л, [L]=0,12 моль/л. Найдите концентрации всех веществ на тот момент времени, когда концентрация L уменьшилась в три раза.
Решение:
При
уменьшении концентрации L
в
три раза, на данный момент времени она
будет равна [L]
= [L]нач
/
3 = 0,12 / 3 =0,4 моль/л. Следовательно, в ходе
реакции израсходовалось некоторое
количество вещества L:
[L]изр
= [L]нач-[L]
= 0,12 – 0,4 = 0,8 моль/л. В случае определения
концентрации вещества К
следует помнить, что вещество L
не
расходуется само по себе, а вступает в
реакцию с К
в соотношении 2
к 1,
т.
е.
![]() ,
отсюдах
= 0,4 моль/л
,
отсюдах
= 0,4 моль/л
_ Значит на данный момент времени концентрация вещества К будет равна [К] = [К]нач-[К]изр = 0,5 – 0,4.= 0,1 моль/л. Также по закону объёмных отношений можно найти и концентрации образованных веществ M и F:
![]() ,
отсюда х = 0,12 моль/л.
,
отсюда х = 0,12 моль/л.
Концентрацию вещества F можно найти таким же образом по концентрации K или L, а можно и полученной концентрации М:
![]() ,
отсюда х = 0,4 моль/л
,
отсюда х = 0,4 моль/л
Поскольку не были даны исходные концентрации этих веществ, то мы можем считать, что начальная концентрация продуктов реакции равна нулю. Следовательно, на тот момент времени, когда концентрация L уменьшилась в три раза, концентрации других веществ будут равны: [К] = 0,1 моль/л;[M] = 0,12 моль/л; [F] =0,4 моль/л
СОВЕТ: в формулу закона необходимо подставлять не начальные или конечные концентрации для исходных веществ, а именно израсходованные, прореагировавшие.
Химическое равновесие
В химических реакциях исходные вещества не всегда полностью превращаются в продукты реакции. Это происходит потому, что по мере накопления продуктов реакции могут создаваться условия для протекания обратимой реакции в противоположном направлении.
Например, если смешать пары иода с водородом при температуре 200 °С, то произойдет реакция:
![]()
Однако известно, что йодистый водород уже при нагревании до 180 °С начинает разлагаться на иод и водород:
![]()
Понятно, что в этих условиях не произойдет ни полного разложения НI, так как продукты реакции способны вновь реагировать между собой, ни полного образования йодистого водорода
Обратимая химическая реакция – это реакция, в ходе которой происходят превращения как в прямом, так и в обратном направлениях, Первым, кто четко сформулировал представление об обратимости химических реакций, был К.Бертолле (1799). Участвуя в Египетской экспедиции Бонапарта, он обратил внимание на образование карбоната натрия в соляных озерах и пришел к заключению, что карбонат натрия образуется в результате взаимодействия между насыщенным раствором хлорида натрия и растворенным карбонатом кальция. Этот процесс обратен проводимой в лаборатории реакции между карбонатом натрия и растворенным хлоридом кальция с образованием карбоната кальция.
При написании уравнений обратимых реакций вместо знака равенства ставят две противоположно направленные стрелки. Уравнение рассмотренной выше обратимой реакции запишется следующим образом:

Реакцию, протекающую слева направо называют прямой (константа скорости прямой реакции k1), справа налево — обратной (константа скорости обратной реакции k2).
В обратимых реакциях скорость прямой реакции вначале имеет максимальное значение, а затем уменьшается вследствие уменьшения концентрации исходных веществ, расходуемых на образование продуктов реакции. И наоборот, обратная реакция в начальный момент имеет минимальную скорость, которая увеличивается по мере увеличения концентрации продуктов реакции. Следовательно, скорость прямой реакции уменьшается, а обратной — увеличивается. Наконец, наступает такой момент, когда скорости прямой и обратной реакций становятся равными.
График изменения скоростей прямой и обратной реакции во времени 1
|
|
График изменения скоростей прямой и обратной реакции во времени 2
 V
V1-
скорость прямой реакции
V
V1-
скорость прямой реакции
V2- скорость обратной реакции
V1=V2 – состояние химического равновесия
V1

 V1=V2
V1=V2
V2

Химическое равновесие - состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
Положение равновесия можно определить, зная скорости прямой и обратной реакций. Уравнение обратимой реакции имеет вид
![]()

согласно закону действующих масс, скорости прямой реакции u1 и обратной u2 соответственно запишутся следующим образом:

В равновесии скорости прямой и обратной реакций равны:
k1[A]m[B]n= k2[C]p[D]q
Состояние химического равновесия количественно характеризуется константой равновесия, представляющей собой отношение констант прямой (K1) и обратной (K2) реакций. Преобразуем эту формулу и получим:
![]()
Константа равновесия зависит от температуры и природы реагирующих веществ. Чем больше константа равновесия, тем больше равновесие сдвинуто в сторону образования продуктов прямой реакции, т. е. численное значение константы равновесия характеризует тенденцию к осуществлению реакции или, другими словами, характеризует выход данной реакции. Так, при К >> 1 выход реакции велик (равновесие смещено в сторону прямой реакции ), так как при этом
![]()
Понятно, что при К << 1 выход реакции мал (.равновесие смещено в сторону обратной реакции ).

