
- •212030, Г. Могилев, пр. Мира, 43
- •1 Растворы
- •1.1 Способы выражения состава растворов
- •1.2 Примеры решения задач
- •1.3 Изменение энтальпии и энтропии системы при растворении
- •1.4 Растворимость. Насыщенные, ненасыщенные и пересыщенные растворы
- •2 Свойства растворов неэлектролитов
- •2.1 Понижение давления пара. Первый закон Рауля
- •2.2 Повышение температуры кипения, понижение температуры замерзания растворов. Второй закон Рауля
- •2.3 Осмос
- •2.4 Примеры решения задач
- •3 Дисперсные системы
- •3.1 Методы получения дисперсных систем
- •3.2 Классификации дисперсных систем
- •3.3 Устойчивость дисперсных систем
- •3.4 Коллоидные растворы
- •В истинных растворах не происходит рассеивания света. Частицы в грубодисперсных системах отражают свет, их величину и форму часто можно установить без оптического увеличения.
- •3.5 Гели
- •Список литературы
В истинных растворах не происходит рассеивания света. Частицы в грубодисперсных системах отражают свет, их величину и форму часто можно установить без оптического увеличения.
3.4.1 Строение коллоидной частицы. При взаимодействии водных растворов нитрата серебра и иодида калия продуктами реакции являются осадок иодида серебра и растворимая соль нитрат калия:
AgNO3 + KJ = AgJ + KNO3.
Но данную реакцию можно провести так, что получится тонкая взвесь иодида серебра – коллоидный раствор – дисперсная система, структурными единицами которой будут являться т. н. коллоидные частицы (гранулы), а дисперсионной средой явлается водный раствор нитрата калия; данная гетерогенная система способна достаточно долго сохранять равномерное распределение частиц дисперсной фазы в дисперсионной среде.
Рассмотрим случай, когда к избытку KJ будем приливать мелкими порциями AgNO3.
Агрегат твердых частиц mAgJобладает избыточной поверхностной энергией. Для того чтобы ее уменьшить, он адсорбирует находящиеся в жидкой дисперсионной среде одноименные ионы, в нашем случае – этоnJ–, и приобретает электрический заряд. Поэтому ионыnJ– называются зарядообразующими (или потенциалопределяющими). Агрегат и адсорбированные зарядообразующие ионы образуют ядро коллоидной частицы, которое притягивает к себе из среды противоионы, т. е.K+. Противоионы гидратированы, и поэтому вместе с ними в коллоидную частицу приходит вода, молекулы которой создают гидратную оболочку.
Таким образом, возникает двойной электрический слой (ДЭС), состоящий из ионов на поверхности (потенциалопределяющих ионов) и из компенсирующих заряд поверхности ионов (противоионов) в растворе (рисунок 6); причем часть противоионов находится в прилегающем к поверхности и прочно связанном с ней адсорбционном слое – (n–x)K+·yH2O, а другая часть – в диффузном слое, удаленном от поверхности –xK+·zH2O.

Рисунок 6 – Двойной электрический слой мицеллы золя
Частицу дисперсной фазы вместе с двойным электрическим слоем называют мицеллой; она является нейтральной.
В общем виде строение мицеллы {[mAgJ·nJ–·(n –x)K+·yH2O]x –+xK+ ·zH2O}o
можно представить так:
{ агрегат потенциалопределяющие ионы противоионы } противоионы
|_ mAgJ____| |______nJ–__________________| |n –x)K+ ·yH2O| |_xK+ ·zH2O_|
|_________________________________________| диффузный слой
ядро
|_____________________________________________|
адсорбционный слой
|___________________________________________________________|
коллоидная частица
|____________________________________________________________________________|
мицелла
Если приготовить золь, приливая мелкими порциями KJ к избытку AgNO3, то образуются коллоидные частицы иного строения (рисунок 7). Ядро то же, что в первом случае, – mAgJ. Одноименными ионами из раствора и поэтому потенциал-определяющими будут являться катионы Ag+ (они в избытке). Соответственно, противоионами из среды – NO3–. В гидратированном виде последние формируют адсорбционный и диффузный слои. Заряд коллоидной частицы – х+. Мицелла имеет вид:
{[mAgJ·nAg+·(n –x)NO3– ·yH2O]х+ + xNO3– ·zH2O}o.
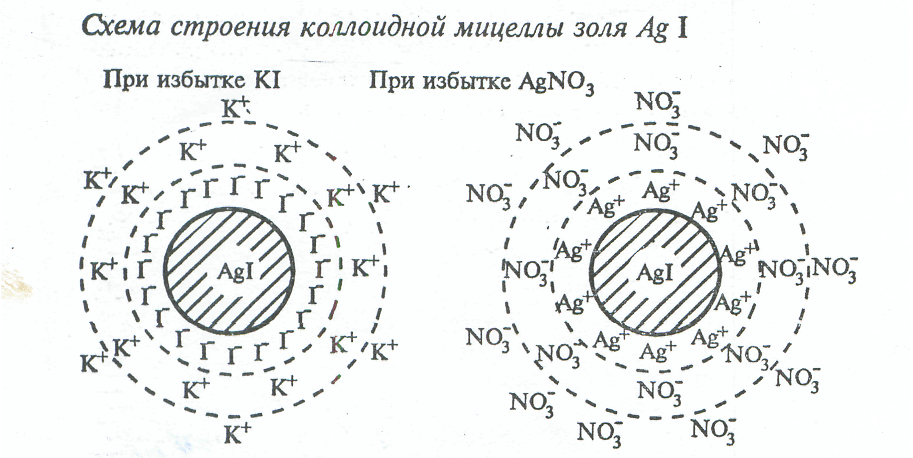
а) – при избытке KJ; б) при избытке AgNO3
Рисунок 7 – Схема строения коллоидной мицеллы золя
При движении частицы в растворе происходит разрыв мицеллы на две части: твердую частицу с противоионами адсорбционного слоя, называемую коллоидной частицей, и противоионы диффузного слоя. Границу, по которой происходит разрыв мицеллы, называют границей скольжения. Плоскость скольжения, как правило, не совпадает с границей, разделяющей адсорбционный и диффузный слои, а несколько смещена от нее в сторону раствора. Электрический потенциал на плоскости скольжения называется электрокинетическим или дзета-потенциалом.
3.4.2 Электрокинетические свойства коллоидных растворов. Наличием на частицах дисперсной фазы ДЭС обусловлены электрокинетические свойства коллоидных растворов: электроосмос, электрофорез.
Перенос частиц дисперсной фазы в электрическом поле к электроду, знак заряда которого противоположен знаку заряда частицы, называется электрофорезом.
Электроосмос – это течение жидкости через капиллярные системы под влиянием разности потенциалов. В случае электроосмоса подвижны гидратированные противоионы, которые увлекают прилегающие к ним слои воды. И так называемый электроосмотический перенос частиц дисперсионной среды направлен к электроду, имеющему тот же знак, что и поверхность капилляра.
Интенсивность всех электрокинетических явлений определяется значением дзета-потенциала. Введение в золь растворов электролитов приводит к изменению строения ДЭС и, как следствие, значения дзета-потенциала.
